题目内容
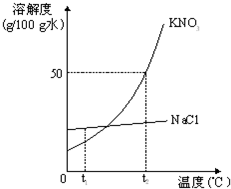 如图为KNO3和NaCl两种物质的溶解度曲线.
如图为KNO3和NaCl两种物质的溶解度曲线.(1)两种物质的溶解度受温度的影响变化较大的是
(2)t1℃时,两种物质溶解度的大小关系为KNO3
(3)t2℃时,将30g KNO3固体投入50g水中,充分溶解后,所得溶液的质量为
(4)若要从混有少量NaCl的KNO3溶液中分离出KNO3,最好采用的方法是
(5)将t2℃的KNO3、NaCl两种物质的饱和溶液,降温至t1℃,所得溶液的溶质质量分数的大小关系是
KNO3
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:根据固体物质的溶解度曲线可以:①比较不同物质在同一温度下的溶解度的大小,②查出某物质在某温度下的溶解度,从而确定一定量的溶剂中最多能溶解的溶质的多少,从而计算出饱和溶液中溶质的质量分数,③判断物质的溶解度随温度变化的变化情况等.
解答:解:(1)根据两物质的溶解度曲线不难看出,溶解度受温度影响较大的是硝酸钾,故答案为:KNO3
(2)根据两物质的溶解度曲线可知,在t1℃时,两物质的溶解度的大小关系是氯化钠>硝酸钾,故答案为:<
(3)由于在t2℃时,硝酸钾的溶解度是50g,即在100g水中最多溶解50g硝酸钾,则在50g水中最多溶解25g硝酸钾,则所得溶液的质量为:50g+25g=75g
(4)对于硝酸钾的溶解度受温度变化影响较大,所以常用冷却热饱和溶液的方法结晶提纯;
(5)由饱和溶液中溶质的质量分数=
×100%,可知溶解度大则溶质的质量分数大;t1℃时,KNO3的溶解度小于NaCl的溶解度,所以两种物质的饱和溶液溶质质量分数硝酸钾的小于氯化钠的;故将t2℃的KNO3、NaCl两种物质的饱和溶液,降温至t1℃,所得溶液的溶质质量分数的大小关系是KNO3<NaCl.
故答案为:
(1)KNO3;(2)<.(3)75g.(4)冷却热饱和溶液的方法结晶提纯.(5)<.
(2)根据两物质的溶解度曲线可知,在t1℃时,两物质的溶解度的大小关系是氯化钠>硝酸钾,故答案为:<
(3)由于在t2℃时,硝酸钾的溶解度是50g,即在100g水中最多溶解50g硝酸钾,则在50g水中最多溶解25g硝酸钾,则所得溶液的质量为:50g+25g=75g
(4)对于硝酸钾的溶解度受温度变化影响较大,所以常用冷却热饱和溶液的方法结晶提纯;
(5)由饱和溶液中溶质的质量分数=
| 溶解度 |
| 溶解度+100g |
故答案为:
(1)KNO3;(2)<.(3)75g.(4)冷却热饱和溶液的方法结晶提纯.(5)<.
点评:本题难度不是很大,主要考查了固体溶解度曲线所表示的意义,并能根据固体的溶解度曲线解决相关的问题,从而培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目