题目内容
把50 g溶质质量分数为30%的硝酸钾溶液与100 g溶质质量分数为10%的硝酸钾溶液充分混合,求混合后溶液中溶质的质量分数.
解析:
| 分析:溶质的质量分数= 解:混合后溶质的质量分数为:
答:混合后溶质的质量分数为17%.
|
提示:

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| 第一次 | 第二次 | 第三次 | |
| 剩余固体的质量/g | 16.75 | 13.50 | 12.40 |
(1)该黄铜合金中,锌元素的质量分数.
(2)第二次实验中放出气体的质量.
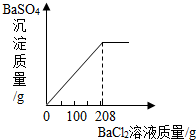
(3)向三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀.所得沉淀的质量与BaCl2溶液质量的关系如图所示,求所用BaCl2溶液的溶质质量分数.
(7分)“ 溶液”在日常生产生活中应用广泛,因而我们要掌握一些有关“物质溶解”的知识。
(1)20℃时,17gKCl溶解在50g水中恰好达到饱和,则该温度下KCl的溶解度为 g 。
(2)相同条件下,氢氧化铜难溶于水,高锰酸钾易溶于水,说明固体物质的溶解能力和溶质的性质有关;请你举例说明固体物质的溶解能力还与什么因素有关?(共1分)
| 影响固体物质的溶解能力 | 举例说明 |
| | |
A.氧化钙B.硝酸铵 C.氢氧化钠D.氯化钠)
(4)下图为氯化铵和硫酸钠的溶解度曲线, 当把相同质量的氯化铵和硫酸钠的饱和溶液从50℃降到20℃时,析出晶体最多的是 。

(5)在40℃时取两份100 g水分别往加入50克氯化铵和50克硫酸钠,充分搅拌后,升温到60℃,下列说法正确的是 。
A.40℃时,两溶液均为饱和溶液
B.40℃时,两溶液质质量分数相等
C.50℃时.两溶液仍为饱和溶液
D.60℃时,硫酸钠溶液仍为饱和溶液,氯化铵溶液为不饱和溶液
E.60℃时,两溶液溶质质量分数相等
F.60℃时,两溶液中溶质质量分数不相等
(7分)“ 溶液”在日常生产生活中应用广泛,因而我们要掌握一些有关“物质溶解”的知识。
(1)20℃时,17gKCl溶解在50g水中恰好达到饱和,则该温度下KCl的溶解度为 g 。
(2)相同条件下,氢氧化铜难溶于水,高锰酸钾易溶于水,说明固体物质的溶解能力和溶质的性质有关;请你举例说明固体物质的溶解能力还与什么因素有关?(共1分)
|
影响固体物质的溶解能力 |
举例说明 |
|
|
|
(3)我们还发现,在用洗衣粉洗衣服时(在等量的水里放等量的洗衣粉),夏天洗衣粉很快溶解了,冬天反复搅拌后往往还会有许多洗衣粉颗粒悬浮水中,这说明洗衣粉的溶解度随着温度升高而______。当你用湿手取少量洗衣粉时,感觉手烫,你认为产生这种现象的原因是 ;若取用X固体代替洗衣粉与水混合,也得到与上述相似的现象,则加入的X固体可能是下列哪种物质 。(填下列选项前的字母)
A.氧化钙B.硝酸铵 C.氢氧化钠D.氯化钠)
(4)下图为氯化铵和硫酸钠的溶解度曲线, 当把相同质量的氯化铵和硫酸钠的饱和溶液从50℃降到20℃时,析出晶体最多的是 。

(5)在40℃时取两份100 g水分别往加入50克氯化铵和50克硫酸钠,充分搅拌后,升温到60℃,下列说法正确的是 。
A.40℃时,两溶液均为饱和溶液
B.40℃时,两溶液质质量分数相等
C.50℃时.两溶液仍为饱和溶液
D.60℃时,硫酸钠溶液仍为饱和溶液,氯化铵溶液为不饱和溶液
E.60℃时,两溶液溶质质量分数相等
F.60℃时,两溶液中溶质质量分数不相等
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 每次加入盐酸量/g | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固体质量/g | 1.5 | 1.0 | 0.5 | 0.4 | 0.4 |
(1)石灰石样品的纯度?
(2)稀盐酸的溶质质量分数是多少?
(3)某次充分反应时所得溶质质量分数?(此时溶液中只含一种溶质)
