题目内容
4.碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.(1)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2(填化学式)的排放量.
(2)如图1为元素周期表中的一格,下列说法不正确的是C(填标号).
A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为
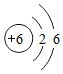
D.碳的相对原子质量为12.01
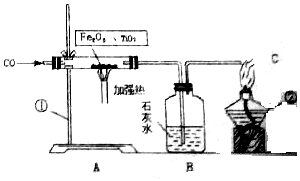
(3)利用图2装置可做CO还原Fe2O3,的实验,并检验该反应生成的气体产物.已知由A装置制取的CO气体中混有少量的CO2.(提示:二氧化碳可以与氢氧化钠溶液反应)
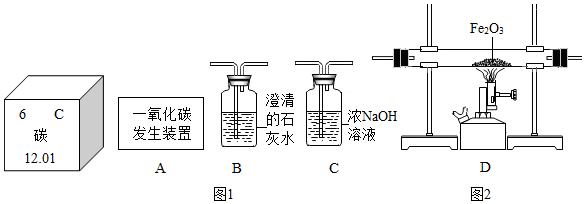
①CO与Fe2O3反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②气体通过装置的顺序是A→CDB(装置不能重复使用).
③请仿照CO2与澄清石灰水的反应原理,写出CO2与氢氧化钠溶液反应的化学方程式CO2+2NaOH=Na2CO3+H2O.
④从环保角度考虑,对以上装置的改进措施是B装置连上集气瓶收集剩余的一氧化碳.
(4)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计).试计算石灰石中杂质的质量分数.
分析 (1)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2 的排放量.
(2)碳元素为质子数为6的元素,其原子的核外电子排布为2,4.其相对原子质量为12.01.
(3)利用图2装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物.已知由A装置制取的CO气体中混有少量的CO2.所以应该先除去二氧化碳然后在让一氧化碳和氧化铁反应,在反应后检测生成物.
(4)根据质量守恒定律可得生成的二氧化碳的质量,进而根据反应的化学方程式求算碳酸钙的质量,然后求算杂质的质量分数.
解答 解:(1)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2 (填化学式,不得填写为名称,否则不得分,另外不要受遇到元素名称就说是元素,而不具体考虑)的排放量.
(2)如图1为元素周期表中的一格,对应的是碳元素的有关信息,其原子的核外的电子排布为2,4,所以C是错误的.
(3)利用图2装置可做CO还原Fe2O3实验,并检验该反应生成的气体产物.已知由A装置制取的CO气体中混有少量的CO2.由于一氧化碳中混有二氧化碳,所以要先排除二氧化碳的干扰,而“提示:二氧化碳可以与氢氧化钠溶液反应“,所以可以用氢氧化钠溶液吸收除去二氧化碳.然后一氧化碳和氧化铁反应,生成气体通入到石灰水中检验二氧化碳的生成.本题更准确的方法是A→C(吸收二氧化碳)→B(证明二氧化碳吸收干净)→D→B,但是题目默认装置不能重复使用,意思只要吸收那就吸收干净了.所以是A→CDB.
①CO与Fe2O3反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②气体通过装置的顺序是A→CDB(装置不能重复使用).
③O2与澄清石灰水生成碳酸钙和水,所以CO2与氢氧化钠溶液反应生成碳酸钠和水,对应化学方程式 CO2+2NaOH=Na2CO3+H2O.
④从环保角度考虑,对以上装置的改进措施是 B装置连上集气瓶收集剩余的一氧化碳.
(4)据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
故答案为:(1)CO2;(2)C;
(3)①3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
②CDB;
③CO2+2NaOH=Na2CO3+H2O.
④B装置连上集气瓶收集剩余的一氧化碳.
(4)据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
点评 逐一解答每一问,过程注意要严格审题,避免答非所谓.根据化学方程式计算要注意格式的完整性,数据的准确性.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 用过的菜刀不用处理 | B. | 给长期放置的铁锅涂油 | ||
| C. | 用“锅丝球”刷铝锅 | D. | 给自行车链条喷漆 |
| A. | Na2CO3--该物质属于氧化物 | |
| B. |  --铈的相对原子质量为140.1g --铈的相对原子质量为140.1g | |
| C. | 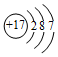 --该原子在反应中易得电子 --该原子在反应中易得电子 | |
| D. | $\stackrel{+2}{Mg}$--“+2”表示镁离子带有两个单位正电荷 |
| A. | 电解水生成氢气和氧气 | B. | 铁在氧气中燃烧 | ||
| C. | 蜡烛在空气中燃烧 | D. | 镁和硫酸反应生成硫酸镁和氢气 |
①Mg ②S ③Fe ④P ⑤Cu.
| A. | ①和④ | B. | 只有③ | C. | ③④⑤ | D. | ③和⑤ |
 科学家发现月球的沙土中含有丰富的含氧钛铁矿.若成分为TiO2、Fe2O3的混合物.现用CO进行还原提炼单质钛和铁.实验装置如图所示.按下列要求进行回答:
科学家发现月球的沙土中含有丰富的含氧钛铁矿.若成分为TiO2、Fe2O3的混合物.现用CO进行还原提炼单质钛和铁.实验装置如图所示.按下列要求进行回答: