题目内容
7.下列物质中既能用浓硫酸干燥,又能用烧碱干燥的一组是( )| A. | CO,CO2 | B. | H2,SO2 | C. | H2,CO | D. | CO2 SO2 |
分析 能用浓H2SO4干燥,又能用NaOH固体干燥,说明该气体不能与这两者反应;浓硫酸不能干燥氨气等溶于水显碱性的气体;氢氧化钠固体不能干燥二氧化碳、二氧化硫、氯化氢等溶于水显酸性的气体.
解答 解:A、CO2能与氢氧化钠反应生成碳酸钠和水,不能用NaOH固体干燥,故选项不符合题意.
B、SO2能与氢氧化钠反应生成亚硫酸钠和水,不能用NaOH固体干燥,故选项不符合题意.
C、氢气、CO既不与浓硫酸反应,也不与氢氧化钠反应,故既可以用浓H2SO4干燥,又可以用NaOH固体干燥,故选项符合题意.
D、CO2能与氢氧化钠反应生成碳酸钠和水,SO2能与氢氧化钠反应生成亚硫酸钠和水,均不能用NaOH固体干燥,故选项不符合题意.
故选:C.
点评 本题难度不大,是对干燥剂知识的考查,掌握干燥剂不能与被干燥的气体发生化学反应是解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.目前,广东省药监局检测出市场上有多种品牌的染发剂中都含有致癌物质--间苯二胺(化学式C6H8N2),下列关于间苯二胺的说法正确的是( )
| A. | 属于混合物 | B. | 碳、氢、氮元素的质量比为6:8:2 | ||
| C. | 由碳、氢、氮三种元素组成 | D. | 氮元素的质量分数为$\frac{2}{6+8+2}$×100% |
2.下列关于水的说法错误的是( )
| A. | 水分子是由两个氢元素和一个氧元素构成的 | |
| B. | 水是由氢元素和氧元素组成的 | |
| C. | 水分子是由两个氢原子和一个氧原子构成的 | |
| D. | 水分子是由氢原子和氧原子构成的 |
12.通过对化学的学习,你已经掌握了实验室制取气体的有关规律,请结合如图1回答问题:
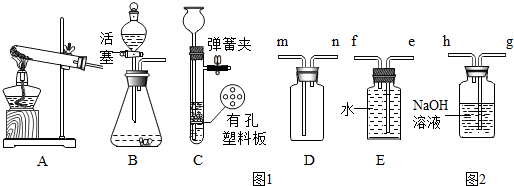
(1)用装置A制氧气.
①用装置A制氧气的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
②冬冬用AD相连制取和收集的氧气,来做铁丝在氧气中燃烧的实验,结果没有观察到剧烈燃烧,火星四射的现象.你认为下列不属于该实验失败的主要原因是B.
A.氧气不纯 B.集气瓶没预先装少量水
C.铁丝太粗 D.系在铁丝上的木柴燃烧尽了,才将铁丝伸入集气瓶
(2)同学们用二氧化锰催化过氧化氢溶液的方法制氧气时,探究了影响化学反应速率的部分因素,实验数据如下表:
①二氧化锰催化过氧化氢溶液的方法制氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②通过实验Ⅰ和Ⅱ对比可知,化学反应速率与反应物浓度有关;从实验Ⅲ和Ⅳ对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快.
③化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是粒子间碰撞的概率越大,化学反应速率越快.
④用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量是减小、不变还是增大呢?不变.
⑤学习了双氧水制氧气的实验后,王林同学想起自己家里有一瓶消毒用的双氧水,经查看发现已过期,他用实验证明了这瓶双氧水已经完全变质.请你猜想王林同学的实验步骤是:取这瓶双氧水放入试管中,加入适量二氧化锰,对应的实验现象是没有气泡产生.
(3)实验室常用硫化亚铁的块状固体与稀盐酸(液体)在常温下反应制硫化氢气体.硫化氢气体是无色有刺激性气味的有毒气体,它的密度比空气大,易溶于水.
①制取硫化氢时选用的发生装置B或C.
②硫化氢气体排放到空气中会污染空气.硫化氢气体可被水吸收,用碱液(如NaOH溶液)吸收效果最好.收集硫化氢气体时,应将n端(选填m、n、e、f)与图2的g端(填g、h)相连.

(1)用装置A制氧气.
①用装置A制氧气的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
②冬冬用AD相连制取和收集的氧气,来做铁丝在氧气中燃烧的实验,结果没有观察到剧烈燃烧,火星四射的现象.你认为下列不属于该实验失败的主要原因是B.
A.氧气不纯 B.集气瓶没预先装少量水
C.铁丝太粗 D.系在铁丝上的木柴燃烧尽了,才将铁丝伸入集气瓶
(2)同学们用二氧化锰催化过氧化氢溶液的方法制氧气时,探究了影响化学反应速率的部分因素,实验数据如下表:
| 实验 序号 | 过氧化氢溶液浓度∕% | 过氧化氢溶液体积∕m L | 温度∕℃ | 二氧化锰的用量∕g | 收集氧气的体积∕m L | 反应所需的时间∕s |
| Ⅰ | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| Ⅱ | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| Ⅲ | 30 | 5 | 35 | 2 | 49.21 | |
| Ⅳ | 30 | 5 | 55 | 2 | 10.76 |
②通过实验Ⅰ和Ⅱ对比可知,化学反应速率与反应物浓度有关;从实验Ⅲ和Ⅳ对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快.
③化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是粒子间碰撞的概率越大,化学反应速率越快.
④用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量是减小、不变还是增大呢?不变.
⑤学习了双氧水制氧气的实验后,王林同学想起自己家里有一瓶消毒用的双氧水,经查看发现已过期,他用实验证明了这瓶双氧水已经完全变质.请你猜想王林同学的实验步骤是:取这瓶双氧水放入试管中,加入适量二氧化锰,对应的实验现象是没有气泡产生.
(3)实验室常用硫化亚铁的块状固体与稀盐酸(液体)在常温下反应制硫化氢气体.硫化氢气体是无色有刺激性气味的有毒气体,它的密度比空气大,易溶于水.
①制取硫化氢时选用的发生装置B或C.
②硫化氢气体排放到空气中会污染空气.硫化氢气体可被水吸收,用碱液(如NaOH溶液)吸收效果最好.收集硫化氢气体时,应将n端(选填m、n、e、f)与图2的g端(填g、h)相连.
19.要验证Fe、Zn、Cu三种金属的活动性顺序,以下能达到目的是( )
| A. | Fe丝、Cu丝、硫酸锌溶液 | |
| B. | Fe丝、Zn片、硫酸铜溶液 | |
| C. | 硫酸铜溶液、硫酸亚铁溶液、Zn片 | |
| D. | Fe丝、Cu丝、Zn片、稀盐酸、硫酸亚铁溶液 |



 ,则该元素的原子序数为20,该元素属于金属(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为+2.
,则该元素的原子序数为20,该元素属于金属(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为+2.