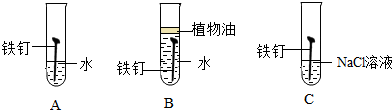
题目内容
4.节假日外出旅游是许多人喜爱的一种休闲方式.(1)在旅途中,很多人选择使用电动车,有效地减少了CO2、SO2、CO的排放,其中CO能与血液中的血红蛋白结合,造成人体中毒;
(2)小明为自己的旅行准备了鸡蛋、面包、橘子和矿泉水,其中富含维生素的是橘子;
(3)汽车表面喷漆主要是为了防锈,其原理是使钢铁与氧气和水隔绝;
(4)与传统汽车相比,太阳能汽车低碳环保,真正实现了零排放.制造太阳能汽车所用的太阳能电池需要大量的单质硅,单质硅是由石英固体(SiO2)与碳在高温条件下反应制得的,反应前后硅元素的化合价分别是+4、0.
分析 (1)根据一氧化碳中毒的知识进行分析;
(2)水果、蔬菜中富含维生素;
(3)与氧气和水隔绝可以防止金属生锈;
(4)根据反应物和生成物及其质量守恒定律可以书写化学方程式,在化合物中元素化合价代数和为零,单质中元素的化合价为零.
解答 解:(1)CO能与血液中的血红蛋白结合,造成人体中毒;
(2)水果、蔬菜中富含维生素,所以小明为自己的旅行准备了鸡蛋、面包、橘子和矿泉水,其中富含维生素的是橘子;
(3)汽车表面喷漆主要是为了防锈,其原理是使钢铁与氧气和水隔绝;
(4)二氧化硅和碳在高温条件下反应能生成硅和一氧化碳,反应的化学方程式为:SiO2﹢2C$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si. 在二氧化硅中,氧元素的化合价是-2价,则硅元素的化合价是+4价,硅单质中硅元素的化合价是0.
故填:(1)血红蛋白;(2)橘子;(3)使钢铁与氧气和水隔绝;(4)+4、0.
点评 本题主要考查一氧化碳中毒、防止生锈的方法和化合物中某元素化合价的求法等方面的知识,知识点较多,但难度不大.

练习册系列答案
相关题目
9.比较归纳是科学学习中的常用方法.若以下的物质转化都由一步反应完成:①Mg→MgCl2 ②Mg(OH)2→MgCl2 ③MgCO3→MgCl2.则( )
| A. | 三种转化发生的都是复分解反应 | B. | 三种转化都必须加入盐酸才能进行 | ||
| C. | 只有②发生了中和反应 | D. | 三种转化的生成物中都有水 |
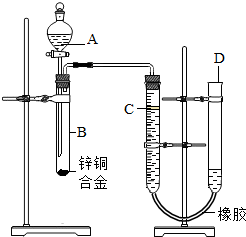 某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)  太阳能路灯系统是利用太阳能进行照明的装置,被越来越广泛地应用.它是由太阳能电池板、蓄电池、LED灯、灯柱、微电脑控制器这五大部分组成.
太阳能路灯系统是利用太阳能进行照明的装置,被越来越广泛地应用.它是由太阳能电池板、蓄电池、LED灯、灯柱、微电脑控制器这五大部分组成.