题目内容
2.在氯化亚铁、氯化铜和氯化镁的混合溶液中加入一定量锌粉,反应停止后过滤,向滤液中插入洁净的铁丝,铁丝表面无明显变化,下列分析正确的是( )| A. | 滤液中一定有氯化镁,可能有氯化锌和氯化亚铁 | |
| B. | 滤液中一定有氯化镁和氯化锌,可能有氯化铜 | |
| C. | 滤渣中一定有铜和铁,可能有锌 | |
| D. | 滤渣中一定有铜,可能有铁和锌 |
分析 镁比锌活泼,锌比铁活泼,铁比铜活泼,在氯化亚铁、氯化铜和氯化镁的混合溶液中加入一定量锌粉,锌不能和氯化镁反应,先和氯化铜反应,后和氯化亚铁反应.
解答 解:A、滤液中一定有不能反应的氯化镁和反应生成的氯化锌,可能有氯化亚铁,该选项说法不正确;
B、滤液中一定有氯化镁和氯化锌,向滤液中插入洁净的铁丝,铁丝表面无明显变化,说明滤液中不含有氯化铜,该选项说法不正确;
C、滤渣中一定有锌和氯化铜反应生成的铜,可能有铁和锌,该选项说法不正确;
D、滤渣中一定有铜,可能有铁和锌,该选项说法正确.
故选:D.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.噻吩(化学式为C4H4S)是一种应用于航空、航天等领域的新材料.下列有噻吩的说法正确的是( )
| A. | 含有2个氢分子 | B. | 碳、氢、硫三种元素质量比是4:4:1 | ||
| C. | 完全燃烧后只生成二氧化碳和水 | D. | 碳元素的质量分数最大 |
13.某班同学按如图所示的实验探究质量守恒定律.

同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据:
其中有问题的两组数据是AD(填序号).进行两次称量的目的是判断反应是否遵循质量守恒定律
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是C(填序号).选择这套装置的原因是反应在密闭容器中进行
A.左盘高 B.右盘高 C.保持平衡
(3)在图2的锥形瓶中添加氢氧化钠的原因是吸收反应生成的二氧化碳,其发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.

同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据:
| A | B | C | D | |
| 盐酸加入Na2CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是C(填序号).选择这套装置的原因是反应在密闭容器中进行
A.左盘高 B.右盘高 C.保持平衡
(3)在图2的锥形瓶中添加氢氧化钠的原因是吸收反应生成的二氧化碳,其发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
10.小松同学在实验室发现一瓶久置在空气中的氢氧化钠固体,小松同学和他们小组同学探究这瓶固体变质程度,取样品13.5g于烧杯中,加入100g水使其完全溶解,逐渐加入一定质量分数的氯化钙溶液,实验数据如下:
( 1 ) 表中m的值3.0g;
(2)求样品中含氢氧化钠的质量分数?(保留到0.1%)
(3)反应前滴加氯化钙溶液的质量分数?
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 加入氯化钙溶液质量/g | 20.0 | 60.0 | 80.0 |
| 生成沉淀质量/g | 1.0 | m | 3.5 |
(2)求样品中含氢氧化钠的质量分数?(保留到0.1%)
(3)反应前滴加氯化钙溶液的质量分数?
17.下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
(1)30℃时,向l00g水中加入45.8g硝酸钾,充分溶解后得到饱和(选填“饱和”或“不饱和”)溶液.
(2)从NaCl溶液中得到NaCl晶体的方法是蒸发溶剂.
(3)从表中数据看,40℃时,氯化钠的溶解度与硝酸钾的溶解度相比更小(填“无法确定”“更大”“更小”).
(4)如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液.若将少量的下列物质,分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是AC(填字母).
A.冰 B.浓硫酸 C.硝酸铵 D.氢氧化钠.

| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
(2)从NaCl溶液中得到NaCl晶体的方法是蒸发溶剂.
(3)从表中数据看,40℃时,氯化钠的溶解度与硝酸钾的溶解度相比更小(填“无法确定”“更大”“更小”).
(4)如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液.若将少量的下列物质,分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是AC(填字母).
A.冰 B.浓硫酸 C.硝酸铵 D.氢氧化钠.
14.下列四个图象中有关量的变动趋势与对应的叙述关系中正确的是( )
| A. | 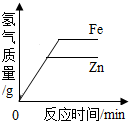 表示等质量的锌和铁分别与足量溶质质量分数相同的稀硫酸反应 | |
| B. | 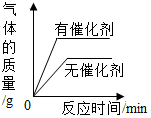 表示完全相同的两份过氧化氢溶液在有、无催化剂条件下的分解 | |
| C. | 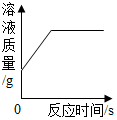 表示向一定量硫酸铜溶液中加入一定量锌粉 | |
| D. | 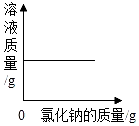 表示向一定量的饱和氯化钠溶液中加入硝酸钾固体 |
11.水常用来配制溶液.
请从27-A或27-B两题中任选1个作答,若两题均作答,按27-A计分.
请从27-A或27-B两题中任选1个作答,若两题均作答,按27-A计分.
| 27-A | 27-B |
| (1)农业上用10%~20%的NaCl溶液进行选种.现要配制15%的NaCl溶液200kg,需要NaCl和水的质量分别是30kg,170kg. (2)氯化钠是由离子(填“分子”“原子”或“离子”)构成. | (1)一定质量分数的KNO3溶液可用作无土栽培的营养液.现将100kg溶质质量分数为15%的KNO3溶液中加水400kg,溶液中溶质质量分数为3%. (2)KNO3为复合肥料,是因为KNO3为植物生长提供了必需的氮和钾元素. |
12.下列生活用品所含的主要材料,属于有机合成材料的是( )
| A. | 铝合金门框 | B. | 瓷碗 | C. | 塑料盆 | D. | 玻璃钢 |
 如图所示,在烧杯A中装入20mL蒸馏水,滴入2-3滴酚酞试液.在烧杯B中装入10mL浓氨水.然后用一只大烧杯把A、B两烧杯溶液罩在一起.过几分钟,可以观察到烧杯A中的溶液变成红色.通过上述现象,得出的结论有:分子是不断运动着的,浓氨水呈碱性(填“酸性”或“碱性”).还可以通过什么方法检测氨水的酸碱性呢?所用的药品的名称pH试纸,产生的现象是试纸由黄色变成蓝色.
如图所示,在烧杯A中装入20mL蒸馏水,滴入2-3滴酚酞试液.在烧杯B中装入10mL浓氨水.然后用一只大烧杯把A、B两烧杯溶液罩在一起.过几分钟,可以观察到烧杯A中的溶液变成红色.通过上述现象,得出的结论有:分子是不断运动着的,浓氨水呈碱性(填“酸性”或“碱性”).还可以通过什么方法检测氨水的酸碱性呢?所用的药品的名称pH试纸,产生的现象是试纸由黄色变成蓝色.