题目内容
12.近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下: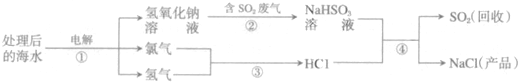
(1)图中从海水最终得到“NaCl(产品)”的过程属于化学变化(填“物理变化”或“化学变化”).NaHSO3属于盐(填氧化物、酸、碱或盐).
(2)图中反应①、③、④属于复分解反应的是④ (填序号).
(3)①中反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(4)反应④的化学方程式为NaHSO3+HCl═NaCl+SO2↑+H2O.
分析 根据变化的特征分析是化学变化还是物理变化;根据反应物和生成物及其质量守恒定律可以书写化学方程式,根据反应的特点可以判断反应的类型等.
解答 解:(1)由海水制取氯化钠的过程中产生了新物质,是化学变化,NaHSO3是由金属和酸根组成的属于盐.
(2)图中反应①是电解食盐水得到了氢氧化钠、氯气和氢气,不属于化学反应的基本类型,反应③是两种物质生成了一种物质属于化合反应、反应④是两化合物相互交换成分生成了两种新的化合物,属于复分解反应;
(3)海水中含有氯化钠,电解海水时生成了氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(4)反应④中亚硫酸氢钠和盐酸反应生成了氯化钠、二氧化硫和水,化学方程式为:NaHSO3+HCl═NaCl+SO2↑+H2O.
故答案为:(1)化学变化,盐;(2)④; (3)2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;(4)NaHSO3+HCl═NaCl+SO2↑+H2O.
点评 本题主要考查了化学方程式的书写及其物质变化的分类等方面的内容,难度不大,根据已有的知识即可分析解答.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
2.下列关于分子和原子的叙述中,正确的是( )
| A. | 分子大原子小 | |
| B. | 分子能运动而原子不能运动 | |
| C. | 分子能构成物质而原子不能构成物质 | |
| D. | 在化学反应中分子可分而原子不可分 |
17.工业生产中,可用盐酸洗去钢铁表面的致密氧化层,但冬天因反应变缓而影响生产.为提高酸洗液的浓度或温度以加快反应,保证生产,可在酸洗液中加入( )
| A. | 浓硫酸 | B. | 生石灰 | C. | 食盐 | D. | 固体氢氧化钠 |
4.某校化学兴趣小组的小伙伴们欲用生石灰制取氢氧化钠固体.他们将生石灰放入烧杯中,然后倒入碳酸钠溶液充分反应,经过滤、洗涤、干燥得到固体A和溶液B.
(1)上述过程中发生的化学反应有(用化学方程式表示):①CaO+H2O=Ca(OH)2;
②Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
【查阅资料】NaOH、Ca(OH)2的溶解度
【猜想与假设Ⅰ】固体A的成分是什么呢?
小王的猜想:CaCO3;小雨的猜想:CaCO3和Ca(OH)2
(2)小雨同学认为固体A中含有Ca(OH)2的理由是Ca(OH)2微溶于水,其中没溶于水的Ca(OH)2留在了固体A中.
【实验与探究】小王和小雨为了验证各自的猜想,分别进行了实验:
【反思与评价】小伙伴们一致认为,上述实验可以证实小雨(填“小王”或“小雨”)同学的猜想正确.
【猜想与假设Ⅱ】溶液B中的溶质是什么呢?
小马的猜想:NaOH和Na2CO3;小东的猜想:NaOH和Ca(OH)2;小龙的猜想:NaOH
【表达与交流】
①结合对固体A成分的探究实验,小伙伴们认为小东同学猜想正确.
②小伙伴们为了获得氢氧化钠固体,他们将溶液B加热浓缩,可是加热不久溶液出现浑浊,只能停止加热.请解释加热时溶液出现浑浊的原因温度升高,Ca(OH)2的溶解度变小而析出.
③小伙伴们立即改变方案,先向B溶液中加入碳酸钠溶液后过滤,再将滤液加热浓缩至饱和,经降温结晶、过滤、洗涤、烘干等操作后,即获得了纯净的氢氧化钠固体.
【拓展与延伸】
①久置的氢氧化钠固体易发生变质,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O.
②实验室有一瓶氢氧化钠暴露在空气中,同学们对其成分进行了研究,称取样品6g,与足量稀盐酸反应后测得生成二氧化碳2.2g,计算该氢氧化钠中碳酸钠的质量分数.
②上述数据不能测定部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是部分变质的NaOH样品中除了NaOH和Na2CO3外,还有H2O存在.
(1)上述过程中发生的化学反应有(用化学方程式表示):①CaO+H2O=Ca(OH)2;
②Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
【查阅资料】NaOH、Ca(OH)2的溶解度
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| NaOH溶解度(g) | 42 | 109 | 129 | 174 | 314 | 347 |
| Ca(OH)2溶解度(g) | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 |
小王的猜想:CaCO3;小雨的猜想:CaCO3和Ca(OH)2
(2)小雨同学认为固体A中含有Ca(OH)2的理由是Ca(OH)2微溶于水,其中没溶于水的Ca(OH)2留在了固体A中.
【实验与探究】小王和小雨为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | |
| 小王 | 取少量固体于试管中,加入稀盐酸 | 产生大量气泡 |
| 小雨 | 取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加无色酚酞试液 | 溶液由无色变为红色 |
【猜想与假设Ⅱ】溶液B中的溶质是什么呢?
小马的猜想:NaOH和Na2CO3;小东的猜想:NaOH和Ca(OH)2;小龙的猜想:NaOH
【表达与交流】
①结合对固体A成分的探究实验,小伙伴们认为小东同学猜想正确.
②小伙伴们为了获得氢氧化钠固体,他们将溶液B加热浓缩,可是加热不久溶液出现浑浊,只能停止加热.请解释加热时溶液出现浑浊的原因温度升高,Ca(OH)2的溶解度变小而析出.
③小伙伴们立即改变方案,先向B溶液中加入碳酸钠溶液后过滤,再将滤液加热浓缩至饱和,经降温结晶、过滤、洗涤、烘干等操作后,即获得了纯净的氢氧化钠固体.
【拓展与延伸】
①久置的氢氧化钠固体易发生变质,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O.
②实验室有一瓶氢氧化钠暴露在空气中,同学们对其成分进行了研究,称取样品6g,与足量稀盐酸反应后测得生成二氧化碳2.2g,计算该氢氧化钠中碳酸钠的质量分数.
②上述数据不能测定部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是部分变质的NaOH样品中除了NaOH和Na2CO3外,还有H2O存在.


