题目内容
1.下列实验现象的描述中,正确的是( )| A. | 硫在氧气中燃烧,产生淡蓝色火焰 | |
| B. | 木炭在空气中燃烧,产生耀眼的白光 | |
| C. | 硝酸铵加入水中溶解,溶液温度明显下降 | |
| D. | 打开盛有浓盐酸的试剂瓶,瓶口有白烟产生 |
分析 A、根据硫在氧气中燃烧的现象进行分析判断.
B、根据木炭在空气中燃烧的现象进行分析判断.
C、根据硝酸铵溶于水的温度变化进行分析判断.
D、根据浓盐酸具有挥发性进行分析判断.
解答 解:A、硫在氧气中燃烧,发出明亮的蓝紫色火焰,故选项说法错误.
B、木炭在空气中燃烧,只能烧至红热,不会产生耀眼的白光,故选项说法错误.
C、硝酸铵加入水中溶解,吸收热量,溶液温度明显下降,故选项说法正确.
D、浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶,白雾出现,而不是白烟,故选项说法错误.
故选:C.
点评 本题难度不大,掌握常见物质燃烧的现象、硝酸铵溶于水的温度变化、浓盐酸具有挥发性即可正确解答,在描述实验现象时,需要注意光和火焰、烟和雾的区别.

练习册系列答案
相关题目
11.请根据如图所示的实验装置图填空.
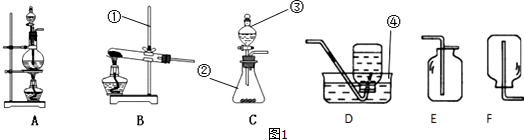
(1)指出图1中标有数字的仪器的名称:①铁架台,②锥形瓶,③分液漏斗,④水槽.
(2)在实验室用高锰酸钾制氧气时应该选择的发生装置是B,装置中还缺少一种实验用品棉花,其作用是防止固体进入导管.写出反应的文字(或符号)表达式:高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气(或2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑).
(3)当用C装置制取氧气时,仪器③内盛放的液体是过氧化氢溶液,反应文字表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
(4)在实验室制取并收集二氧化碳可选用CE 装置(填字母编号),写出实验室制取二氧化碳反应的文字表达式:碳酸钙+盐酸→氯化钙+水+二氧化碳.验证二氧化碳收集满的方法是燃着的木条放在集气瓶口.
(5)氢气是一种密度比空气小的气体,难溶于水.实验室常用金属锌粒和稀硫酸在常温下反应来制取氢气.实验室制取氢气的发生装置可以选择上图中的C装置,收集氢气可以选择上图中的D或F装置.
(6)实验室用加热二氧化锰和浓盐酸混合物的方法制取氯气,应该选择的发生装置是A.
(7)图2所示装置也可以用来收集气体.如果用该装置收集二氧化碳,气体应该从A导管通入.如果用排水法收集氧气,应该先在该装置中装满水,然后将氧气从B导管通入.
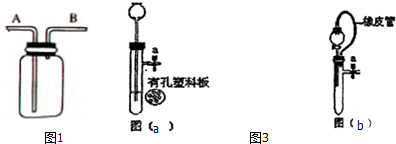
(8)小宋同学对气体发生装置作了改进,设计了如图3的装置,如图3(a)所示.使用图3(a)装置制取CO2,反应进行过程中,关闭该装置中的止水夹a后,可以观察到的现象液体被压回长颈漏斗中,固液分离,反应停止.
(9)小亮同学也改进了气体发生装置,改进的装置如图3(b)所示,与C装置相比较,橡皮管的作用是平衡气压或使分液漏斗和试管中的压强一致,便于液体滴落下来.
(10)小明同学探究了影响双氧水分解速度的某种因素.实验数据记录如下:
实验结论:在相同条件下,双氧水的浓度越大,双氧水分解得越快.

(1)指出图1中标有数字的仪器的名称:①铁架台,②锥形瓶,③分液漏斗,④水槽.
(2)在实验室用高锰酸钾制氧气时应该选择的发生装置是B,装置中还缺少一种实验用品棉花,其作用是防止固体进入导管.写出反应的文字(或符号)表达式:高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气(或2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑).
(3)当用C装置制取氧气时,仪器③内盛放的液体是过氧化氢溶液,反应文字表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
(4)在实验室制取并收集二氧化碳可选用CE 装置(填字母编号),写出实验室制取二氧化碳反应的文字表达式:碳酸钙+盐酸→氯化钙+水+二氧化碳.验证二氧化碳收集满的方法是燃着的木条放在集气瓶口.
(5)氢气是一种密度比空气小的气体,难溶于水.实验室常用金属锌粒和稀硫酸在常温下反应来制取氢气.实验室制取氢气的发生装置可以选择上图中的C装置,收集氢气可以选择上图中的D或F装置.
(6)实验室用加热二氧化锰和浓盐酸混合物的方法制取氯气,应该选择的发生装置是A.
(7)图2所示装置也可以用来收集气体.如果用该装置收集二氧化碳,气体应该从A导管通入.如果用排水法收集氧气,应该先在该装置中装满水,然后将氧气从B导管通入.

(8)小宋同学对气体发生装置作了改进,设计了如图3的装置,如图3(a)所示.使用图3(a)装置制取CO2,反应进行过程中,关闭该装置中的止水夹a后,可以观察到的现象液体被压回长颈漏斗中,固液分离,反应停止.
(9)小亮同学也改进了气体发生装置,改进的装置如图3(b)所示,与C装置相比较,橡皮管的作用是平衡气压或使分液漏斗和试管中的压强一致,便于液体滴落下来.
(10)小明同学探究了影响双氧水分解速度的某种因素.实验数据记录如下:
| 双氧水的质量 | 双氧水的浓度 | MmO2的质量 | 相同时间内产生O2体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
16. 水和溶液在生命活动和生产、生活中起着十分重要的作用
水和溶液在生命活动和生产、生活中起着十分重要的作用
(1)小红同学利用如图1装置对学校附近某河水的水质进行净化,经过此装置后,所得水为混合物(填“纯净物”或“混合物”),其中活性炭的主要作用是吸附
(2)节约水资源,防止水污染是每个公民应尽的责任和义务,下列做法会造成水体污染的有AD(填序号)
A.工业废水直接排放 B.工业废气处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量.测定结果记录如下表:
若不考虑水蒸发对实验的影响,请回答下列问题:
①65℃时,该溶液是无法判断(填“饱和溶液”、“不饱和溶液,或“无法判断”).
②40℃时接近饱和的M溶液变成饱和溶液,下列方法中能达到目的有BCD(填字母序号)
A.升温 B.降温 C.加固体M D.恒温蒸发水
(4)某些地方的饮用水中含有少量的Ca(HCO3)2等可溶性盐.烧水时,Ca(HCO3)2发生分解反应,生成难溶性的CaCO3.试写出Ca(HCO3)2受热分解的化学方程式Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O
(5)如图2所示实验,将水加入到试管中,观察到A液面下降,B液面上升,饱和石灰水变浑浊,则X固体可能为
NaOH、CaO(写出两种不同物质的化学式,由此实验现象得到的结论是固体遇水放热,氢氧化钙溶解度随温度升高而降低.
 水和溶液在生命活动和生产、生活中起着十分重要的作用
水和溶液在生命活动和生产、生活中起着十分重要的作用(1)小红同学利用如图1装置对学校附近某河水的水质进行净化,经过此装置后,所得水为混合物(填“纯净物”或“混合物”),其中活性炭的主要作用是吸附
(2)节约水资源,防止水污染是每个公民应尽的责任和义务,下列做法会造成水体污染的有AD(填序号)
A.工业废水直接排放 B.工业废气处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量.测定结果记录如下表:
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质置/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
①65℃时,该溶液是无法判断(填“饱和溶液”、“不饱和溶液,或“无法判断”).
②40℃时接近饱和的M溶液变成饱和溶液,下列方法中能达到目的有BCD(填字母序号)
A.升温 B.降温 C.加固体M D.恒温蒸发水
(4)某些地方的饮用水中含有少量的Ca(HCO3)2等可溶性盐.烧水时,Ca(HCO3)2发生分解反应,生成难溶性的CaCO3.试写出Ca(HCO3)2受热分解的化学方程式Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+CO2↑+H2O
(5)如图2所示实验,将水加入到试管中,观察到A液面下降,B液面上升,饱和石灰水变浑浊,则X固体可能为
NaOH、CaO(写出两种不同物质的化学式,由此实验现象得到的结论是固体遇水放热,氢氧化钙溶解度随温度升高而降低.
 液化石油气是常用的燃料.请回答:
液化石油气是常用的燃料.请回答: A、B、C是初中化学常见的不同类型的物质,它们之间有如图转化关系,“-”表示两种物质相互反应,“→”表示由反应物转化到生成物.A是人体胃液中含有的酸,B为当今年产量最多的金属.回答下列问题:
A、B、C是初中化学常见的不同类型的物质,它们之间有如图转化关系,“-”表示两种物质相互反应,“→”表示由反应物转化到生成物.A是人体胃液中含有的酸,B为当今年产量最多的金属.回答下列问题: 某化学兴趣小组对“制镁企业不能使用CO2作为消防器材”的问题进行探讨,请你参与他们的活动.
某化学兴趣小组对“制镁企业不能使用CO2作为消防器材”的问题进行探讨,请你参与他们的活动.