题目内容
10.小明同学为探究“NaOH与稀盐酸反应是放热反应还是吸热反应”,设计并进行了3次重复实验,结果如表:请你帮助填写相关内容:
| 试剂1 | 试剂2 | 混合前温度/℃ | 混合后温度/℃ | |
| 35毫升稀盐酸 | 25毫升NaOH溶液 | 20.0 | 第1次 | 24.2 |
| 第2次 | 24.0 | |||
| 第3次 | 24.4 | |||
(2)该实验中所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是温度计;
(3)由上表数据可知:NaOH溶液与稀盐酸的反应是放热(选填:“放热”或“吸热”)反应.能否由此进一步推知NaOH固体与稀盐酸反应是放热反应还是吸热反应,请说明理由:不能,氢氧化钠固体溶于水也会放热.
分析 根据氢氧化钠与稀盐酸反应后温度升高,可知此反应为放热反应;氢氧化钠固体溶于水放热,据此解答.
解答 解:根据氢氧化钠和稀盐酸反应三次重复实验,反应后溶液的温度升高,可知氢氧化钠与盐酸反应是放热反应,所用仪器除了除烧杯、量筒、玻璃棒、保温瓶外,还必须用到温度计;因为氢氧化钠固体溶于水放热,所以不能由此进一步推知NaOH固体与稀盐酸反应是放热反应还是吸热反应.
故答案为:
(1)HCl+NaOH═NaCl+H2O;
(2)温度计;
(3)放热;不能,氢氧化钠固体溶于水也会放热.
点评 本题旨在考查学生阅读信息、处理信息的能力,中考题中此类题所占比重也在逐年变大,因此在乎时学习中要加以注意.

练习册系列答案
相关题目
20.请按照所指定的化合价,填写下表中结合成的化合物的化学式
| $\stackrel{+1}{H}$ | $\stackrel{+1}{Na}$ | $\stackrel{+2}{Zn}$ | $\stackrel{+2}{Fe}$ | $\stackrel{+3}{Fe}$ | |
| $\stackrel{-2}{O}$ | |||||
| $\stackrel{-1}{Cl}$ | |||||
| $\stackrel{-1}{OH}$ | |||||
| $\stackrel{-2}{S{O}_{4}}$ |
5. 在一只盛有稀硫酸的烧杯中漂浮着一块木块(如图)往烧杯中加入少量的某中固体物质后,木块浸没在液体中的体积变大(假设这些过程中溶液的体积变化忽略不计),则加入的固体物质可能是( )
在一只盛有稀硫酸的烧杯中漂浮着一块木块(如图)往烧杯中加入少量的某中固体物质后,木块浸没在液体中的体积变大(假设这些过程中溶液的体积变化忽略不计),则加入的固体物质可能是( )
 在一只盛有稀硫酸的烧杯中漂浮着一块木块(如图)往烧杯中加入少量的某中固体物质后,木块浸没在液体中的体积变大(假设这些过程中溶液的体积变化忽略不计),则加入的固体物质可能是( )
在一只盛有稀硫酸的烧杯中漂浮着一块木块(如图)往烧杯中加入少量的某中固体物质后,木块浸没在液体中的体积变大(假设这些过程中溶液的体积变化忽略不计),则加入的固体物质可能是( )| A. | Na2CO3 | B. | Fe | C. | Ba(OH)2 | D. | CuO |
6.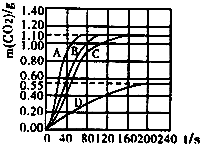 化学实验小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.
化学实验小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.
[提出问题]盐酸与大理石反应的快慢受哪些因素的影响呢?
[猜想与假设]a.可能与盐酸浓度有关;b.可能与温度有关;c.可能与大理石规格有关
[设计并实验]
(1)请完成如表实验设计表,并在实验目的一栏中填写对应的实验编号.
(2)请写出大理石与盐酸反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑
[数据整理]
实验①中CO2质量随时间变化的关系如图.
[分析数据]
(3)如图图形中有四条曲线,其中实验③对应的曲线为B,即③-B.请写出能反映其它三组实验对应的曲线④-A,①-C,②-D.
(4)以上方法是通过测量产生气体快慢来判断化学反应的快慢,还可以借助其它反应现象来判断反应的快慢,你认为是固体减少的快慢.
 化学实验小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.
化学实验小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.[提出问题]盐酸与大理石反应的快慢受哪些因素的影响呢?
[猜想与假设]a.可能与盐酸浓度有关;b.可能与温度有关;c.可能与大理石规格有关
[设计并实验]
(1)请完成如表实验设计表,并在实验目的一栏中填写对应的实验编号.
| 实验 编号 | 温度(℃) | 大理石 规格 | 盐酸浓度(均取100mL) | 实验目的 |
| ① | 20 | 粗颗粒 | 20% | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和探究温度对该反应速率的影响; (Ⅲ)实验①和探究大理石规格(粗、细)对该反应速率的影响; |
| ② | 20 | 粗颗粒 | 10% | |
| ③ | 细颗粒 | 20% | ||
| ④ | | 粗颗粒 | 20% |
[数据整理]
实验①中CO2质量随时间变化的关系如图.
[分析数据]
(3)如图图形中有四条曲线,其中实验③对应的曲线为B,即③-B.请写出能反映其它三组实验对应的曲线④-A,①-C,②-D.
(4)以上方法是通过测量产生气体快慢来判断化学反应的快慢,还可以借助其它反应现象来判断反应的快慢,你认为是固体减少的快慢.
7.下列关于碳及其化合物的说法正确的是( )
| A. | CO和CO2的性质不同是因为分子的构成不同 | |
| B. | 在室内放一盆水可防止CO中毒 | |
| C. | 一氧化碳和二氧化碳都具有还原性 | |
| D. | 铅笔字迹易变模糊是因为常温下石墨化学性质活泼 |
 如图是实验室木炭还原氧化铜的实验,请回答:
如图是实验室木炭还原氧化铜的实验,请回答: