题目内容
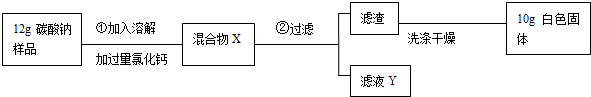
15.松花蛋,又称皮蛋、卞蛋.其中一种加工工艺的主要原料配方为:鸭蛋10Kg,水10Kg,生石灰1.2Kg,纯碱0.53Kg,食盐0.35Kg.加工时,将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.请回答下列问题:
(1)鸭蛋中富含的营养素有水和蛋白质.
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是氧化钙与水反应能放出大量的热.
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色
(4)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl
②可能还含有其它溶质:甲同学推断只有Ca(OH)2,乙同学推断只有Na2CO3,丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(用化学方程式表示).
【实验探究】
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是酸碱起中和反应.
②料液中起主要作用的是烧碱.现行配方中,直接用烧碱代替石灰和纯碱作用生成的烧碱.若加工10Kg的鸭蛋,需要烧碱的质量是多少千克?(请写出计算过程)
分析 (1)根据鸭蛋中富含的营养素分析回答;
(2)根据氧化钙与水的反应分析;
(3)根据氢氧化钙溶液显碱性回答;
(4)【交流讨论】根据氢氧化钙与碳酸钠的反应分析丙同学的判断;
【探究结论】根据实验探究中氢氧化钙与碳酸钠的反应分析料液中含有的物质;
【知识应用】①根据酸能与碱反应分析;
②根据生石灰与水的反应氢氧化钙,氢氧化钙与碳酸钠的反应分析计算.
解答 解:(1)鸭蛋中富含的营养素有水和蛋白质;
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是氧化钙与水反应能放出大量的热;
(3)上层料液是氢氧化钙的溶液,显碱性,稀释后滴加无色酚酞试液,清液应变为红色;
(4)【交流讨论】由于氢氧化钙与碳酸钠的反应,两种物质不能同时存在,发生的反应是,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.所以丙同学的推断是错误的;
【探究结论】由于向溶液中加入碳酸钠产生了沉淀,说明了溶液中含有氢氧化钙,所以,甲同学的推断是正确的;
【知识应用】①蛋食用时加入一些食醋,可以去除氨味和涩感,原因是酸碱起中和反应;
②设生成的氢氧化钙的质量为x
CaO+H2O=Ca(OH)2
56 74
1.2kg x
$\frac{56}{1.2kg}$=$\frac{74}{x}$
解得:x=1.6kg
由Ca(OH)2+Na2CO3═CaCO3↓+2NaOH可知,氢氧化钙与碳酸钠的质量比为74:106.所以,纯碱是不足量的,应根据纯碱的质量进行计算;
设生成的氢氧化钠的质量为y
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
106 80
0.53kg y
$\frac{106}{0.53g}$=$\frac{80}{y}$
解得:y=0.4kg
故答为:(1)蛋白质;(2)氧化钙与水反应能放出大量的热;(3)红;(4)【交流讨论】Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;【探究结论】甲;【知识应用】①酸碱起中和反应;②需要烧碱的质量是0.4千克.
点评 本题是一道综合题,涉及的知识点较多,本题中掌握氢氧化钙与碳酸钠的反应是解题的关键.

| A. | 7.2g | B. | 5.8g | C. | 4.4g | D. | 9.5 g |
【查阅资料】天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).有关物质的溶解性见下表:
部分钙、镁化合物溶解性表(20℃)
 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
CaCO3和Mg(OH)2,可能含有Ca(OH)2和MgCO3(填化学式).
【设计方案】
实验1:确定水垢中是否含Ca(OH)2和CaCO3
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 没有白色沉淀产生 | 没有氢氧化钙 |
利用下列实验装置,完成实验2探究.其主要实验步骤如下:

称量D、E装置总质量为200.0g,按上图组装后,将2.5g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为201.25g(碱石灰主要成分为CaO和NaOH,不考虑装置内空气对实验的影响).
【实验讨论】
(1)加入样品前还应检查装置的气密性,装置B中盛放稀盐酸的仪器名称为分液漏斗,装置C的作用是除去二氧化碳中含有的水蒸气,反应结束后打开止水夹K,缓缓鼓入空气的目的是将残留在装置中的二氧化碳全部排入D、E装置中充分吸收,装置A的作用是吸收空气中的二氧化碳.A、B装置之间不要设置干燥装置(填“要”、“不要”),其理由是C装置可以除去二氧化碳的水蒸气.
(2)装置B中生成气体的化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑(只要求写一种)
装置D中的化学反应方程式为CO2+2NaOH═Na2CO3+H2O.
(3)装置B中生成CO2的质量为4.4 g.通过计算说明水垢中A含MgCO3(填字母).
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知CaCO3相对分子质量为100、MgCO3相对分子质量为84):
实验3:确定水垢中是否含有Mg(OH)2
另取质量为2.50g水垢,加3.65%稀盐酸与之反应,测得消耗稀盐酸w g.结合以上实验,判断当w的值满足w>56.8 条件时,水垢中一定含有Mg(OH)2(请通过计算说明).