题目内容
9.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾.现从草木灰中提取钾盐,并用实验检验其中的 CO32-、SO42-、和 Cl(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,③过滤,④蒸发,⑤冷却结晶.
(2)用托盘天平称量样品时,若指针偏向右边,则表示B(填选项的标号).
A、左盘重,样品轻 B、左盘轻,砝码重
C、右盘重,砝码轻 D、右盘轻,样品重
(3)在进行②、③、④操作时,都要用到玻璃棒,其作用分别是:
②加快溶解;③引流;④使液体受热均匀.
(4)将制得的少量晶体放入试管,加热蒸馏水溶解并把溶液分成两份,分装在2支试管里.
①在第一支试管里加入稀盐酸,可观察有气泡生成,证明溶液中有CO32-离子.
②在第二支试管里加入足量盐酸后,再加入BaCl2溶液,可观察到有白色沉淀生成,证明溶液中有SO42-离子.
③取第二支试管反应后的滤液加入足量稀硝酸后,再加入 AgNO3 溶液,可观察到有白色沉淀生成,否(填“是”或“否”)能证明草木灰中含有Cl-离子,理由是氯化钡和硫酸钾反应生成了氯化钾,即使草木灰中不含有氯离子,也能够产生氯化银沉淀.
分析 根据实验现象可以判断实验结论;
根据玻璃棒的用途有转移物质、搅拌、引流等进行分析;
根据氢离子能和碳酸根离子结合生成水和二氧化碳进行分析;
根据钡离子能和硫酸根离子结合生成白色沉淀硫酸钡;氯离子能和银离子结合生成白色沉淀氯化银进行分析.
解答 解:(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解沉降,③过滤,④蒸发,⑤冷却结晶;
(2)用托盘天平称量样品时,若指针偏向右边,则表示左盘轻,砝码重,故选:B;
(3)在进行②、③、④操作时,都要用到玻璃棒,其作用分别是:②加快溶解;③引流;④使液体受热均匀;
(4)①在第一支试管里加入稀盐酸,可观察有气泡生成,证明溶液中有 CO32-;
②在第二支试管里加入足量盐酸后,再加入 BaCl2 溶液,可观察到有白色沉淀生成,证明溶液中有SO42-;
③氯化钡和硫酸钾反应生成了氯化钾,即使草木灰中不含有氯离子,也能够产生氯化银沉淀,因此观察到有白色沉淀生成,不能证明草木灰中含有氯离子.
故答案为:(1)过滤,蒸发;
(2)B;
(3)加快溶解,引流,使液体受热均匀;
(4)①气泡,CO32-;
②白色沉淀,SO42-;
③否;氯化钡和硫酸钾反应生成了氯化钾,即使草木灰中不含有氯离子,也能够产生氯化银沉淀.
点评 本题主要考查物质的性质,只有掌握了物质的性质,才能够对各种问题作出正确的解答.

练习册系列答案
相关题目
19.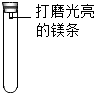 镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.
镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应.
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关
【进行实验】通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天.
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示)
(2)实验1的目的是检验只用氧气是否会使镁条变黑
(3)实验3中,试管内的气体主要含有CO2、氧气、氮气.
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是2、5(填编号)
(5)由上述实验可推知,镁条变黑的条件是水、二氧化碳、氧气.
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是氮气的化学性质不活泼,很难与其它物质反应
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是稀盐酸和澄清的石灰水.
 镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.
镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应.
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关
【进行实验】通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天.
| 编号 | 主要实验操作 | 实验现象 |
| 1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
| 2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
| 3 | 先加入2mL浓硫酸再通入约4mLCO2 | 镁条始终无明显变化 |
| 4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
| 5 | 先加入2mL蒸馏水再通入约4mLCO2 | 镁条第3天开始变黑至第20天全部变黑 |
(1)实验1和2中,NaOH浓溶液的作用是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示)
(2)实验1的目的是检验只用氧气是否会使镁条变黑
(3)实验3中,试管内的气体主要含有CO2、氧气、氮气.
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是2、5(填编号)
(5)由上述实验可推知,镁条变黑的条件是水、二氧化碳、氧气.
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是氮气的化学性质不活泼,很难与其它物质反应
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是稀盐酸和澄清的石灰水.
20.实验室制取气体所需装置如图1所示.

请回答以下问题:
(1)写出仪器a的名称:长颈漏斗;
(2)B中小试管的作用:液封或节约药品或可控制反应;
(3)甲烷是一种无色无味的气体,难溶于水,密度比空气小且不与空气反应.用加热无水醋酸钠和碱石灰的固体混合物制取较纯净的甲烷,应选择的制取装置是AC;
(4)双球洗气管常用于气体除杂、干燥、吸收(可防倒吸)等实验.为吸收某气体并检验其性质进行图2中实验,发现紫色石蕊试液变色.请根据表中的数据判断左方进入的气体可能是BC(填字母).
A.O2 B.HCl C.NH3 D.CO2.

请回答以下问题:
(1)写出仪器a的名称:长颈漏斗;
(2)B中小试管的作用:液封或节约药品或可控制反应;
(3)甲烷是一种无色无味的气体,难溶于水,密度比空气小且不与空气反应.用加热无水醋酸钠和碱石灰的固体混合物制取较纯净的甲烷,应选择的制取装置是AC;
(4)双球洗气管常用于气体除杂、干燥、吸收(可防倒吸)等实验.为吸收某气体并检验其性质进行图2中实验,发现紫色石蕊试液变色.请根据表中的数据判断左方进入的气体可能是BC(填字母).
| O2 | HCl | NH3 | CO2 | |
| 通常情况下,1体积水 能吸收的气体的体积 | 0.031 | 500 | 700 | 1 |
17.根据如图五种粒子的结构示意图,所获取的信息正确的是( )


| A. | ①②属于第三周期元素,③④属于第二周期元素 | |
| B. | ③④、②⑤的化学性质相似 | |
| C. | ①元素最高正价为+6价,负价为-2价 | |
| D. | ①②表示的是原子,而③④⑤表示的是阴离子 |
1. 如图是A、B、C三种物质的曲线,下列分析正确的是( )
如图是A、B、C三种物质的曲线,下列分析正确的是( )
 如图是A、B、C三种物质的曲线,下列分析正确的是( )
如图是A、B、C三种物质的曲线,下列分析正确的是( )| A. | 50℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C | |
| B. | 50℃100gA溶液中含A的质量为50g | |
| C. | 将C的饱和溶液变为不饱和溶液,采用降温结晶方法 | |
| D. | 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C |
18. 甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中正确的是( )
甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中正确的是( )
 甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中正确的是( )
甲、乙两种不含结晶水的固体物质的溶解性曲线如图,下列说法中正确的是( )| A. | t2℃时,甲、乙两种饱和溶液中溶质的质量分数相等 | |
| B. | t1℃时,甲的饱和溶液中溶质与溶液的质量比为1:5 | |
| C. | 甲的溶解度比乙大 | |
| D. | 将等质量甲、乙的两种溶液分别由t3℃降温至t2℃,析出甲的质量一定比析出乙的质量大 |
19.“冰毒”是毒性极强的毒品之一,其化学式为C10H15N,下列有关冰毒解释错误的是( )
| A. | 冰毒是由碳、氢、氮三种元素组成的化合物 | |
| B. | 冰毒是一种有机物,完全燃烧只生成CO2和H2O | |
| C. | 冰毒中氮原子的原子结构示意图为 | |
| D. | 冰毒中碳、氢两种元素质量比为24:3 |
 碳和碳的部分化合物间的部分转化关系如图所示:
碳和碳的部分化合物间的部分转化关系如图所示: