题目内容
18.某石灰厂需要测定产品石灰石中CaCO3的质量分数.小刚进行了如下实验,称取12g石灰石样品(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入100g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为107.6g.请计算:(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数.
分析 (1)根据质量守恒定律,反应前后减少的质量为二氧化碳的质量.
(2)利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量,进而可求样品中杂质的质量,即可求出石灰石中杂质的质量分数.
解答 解:(1)依据质量守恒定律可知生成CO2的质量为:12g+100g-107.6g=4.4g;
(2)设石灰石中CaCO3的质量为x,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
$\frac{100}{x}=\frac{44}{4.4g}$
x=10g
样品中CaCO3的质量分数为:
$\frac{10g}{12g}$×100%=83.3%
答:石灰石中杂质的质量分数为83.3%.
点评 根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算,有关反应前后质量减少的计算是初中化学计算的一个常见内容,一般的规律是依据质量的变化求出某一生成的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列容器不能盛放硫酸铜溶液的是( )
| A. | 塑料容器 | B. | 铁质容器 | C. | 铜质容器 | D. | 银质容器 |
13.下列物质的用途是利用其物理性质的是( )
| A. | 液态二氧化碳用于灭火 | B. | 石灰浆用于砌砖抹墙 | ||
| C. | 氢气用于发射火箭 | D. | 石墨作干电池电极 |
10.实验室制取二氧化碳的药品是( )
| A. | 大理石与稀硫酸 | B. | 浓盐酸与大理石 | ||
| C. | 石灰石与稀盐酸 | D. | 碳酸钠粉末与稀盐酸 |
7.下列做法不正确的是( )
| A. | 做化学实验时,取出的多余药品应放回到原试剂瓶中,避免浪费 | |
| B. | 易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 | |
| C. | 不慎将酒精灯碰倒,洒出的酒精在桌上燃烧起来,立刻用湿布扑灭 | |
| D. | 不慎将氢氧化钠溶液沾到皮肤上,立即用大量水冲洗,再涂上硼酸溶液 |
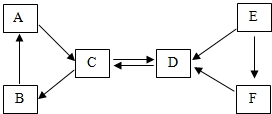 现有A-F六种常见物质,其中B是食品包装中常用的干燥剂氧化钙,A.B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素.它们的转化关系如图所示.请回答:
现有A-F六种常见物质,其中B是食品包装中常用的干燥剂氧化钙,A.B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素.它们的转化关系如图所示.请回答: