题目内容
3.如图所示,烧杯中盛有80℃的热水,杯底放有一小粒白磷,当将一支大试管迅速插入水中并罩住白磷时,白磷立即燃烧起来.该实验说明燃烧需要( )
| A. | 水 | B. | 氧气 | C. | 可燃物 | D. | 温度达到着火点 |
分析 根据物质燃烧的条件分析解答:物质燃烧条件:可燃物;与充足氧气接触,温度达到着火点,三个条件同时具备分析.
解答 解:因为热水中的白磷没有与氧气接触,所以不能燃烧;当将一支大试管迅速插入水中并罩住白磷时,白磷立即燃烧起来,是因为与氧气接触了,所以该实验说明燃烧需要氧气.
故选:B.
点评 本题考查了物质燃烧的条件,物质燃烧的三个条件缺一不可,所以灭火只要消灭其中的一个条件,就可达到灭火的目的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.测得生活中一些物质的pH如下表,判断下列说法错误的是( )
| 物质 | 肥皂水 | 食盐水 | 唾液 | 柠檬汁 | 洗涤剂 |
| pH | 10.2 | 7.0 | 6.8 | 2.5 | 12.2 |
| A. | 洗涤剂能使无色酚酞试液变红 | B. | 肥皂水能使紫色石蕊试液变蓝 | ||
| C. | 食盐水是中性物质 | D. | 柠檬汁的酸性比唾液弱 |
11.下列叙述正确的是( )
| A. | 将pH试纸浸入溶液中测溶液的pH | |
| B. | 用100 mL的量筒量取5.55 mL的稀硫酸 | |
| C. | 将氢氧化钠固体直接放在托盘天平的托盘上称量 | |
| D. | 粗盐提纯主要步骤是:溶解、过滤、蒸发 |
18. 某反应的微观示意图如图所示.请分析下列说法正确的是( )
某反应的微观示意图如图所示.请分析下列说法正确的是( )
 某反应的微观示意图如图所示.请分析下列说法正确的是( )
某反应的微观示意图如图所示.请分析下列说法正确的是( )| A. | 反应前的物质都是化合物 | |
| B. | 反应后的物质是氧气和二氧化碳的混合物 | |
| C. | 整个反应是2种物质反应生成另外2种物质 | |
| D. | 整个实验过程中,该反应化学方程式为2SO2+O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$2SO3 |
2.研究小组进行木炭还原氧化铁的探究活动.将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨.取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失).
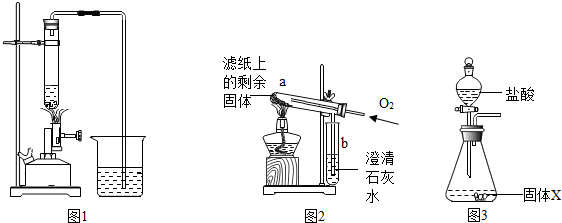
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的氧化物及其部分性质如下:
Fe2O3为红色固体; Fe3O4和FeO均为黑色固体.其中,Fe3O4具有很好的磁性,能被磁铁吸引.三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl═2FeCl3+3H₂O
Fe3O4+8HCl═2FeCl3+FeCl2+4H2O
FeO+2HCl═FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3 ⑤C
【实施实验】
目的:确定固体X的组成.
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
【获得结论】
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X的成分及质量分别是C是1.1g,Fe是16.8g.

【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的氧化物及其部分性质如下:
Fe2O3为红色固体; Fe3O4和FeO均为黑色固体.其中,Fe3O4具有很好的磁性,能被磁铁吸引.三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl═2FeCl3+3H₂O
Fe3O4+8HCl═2FeCl3+FeCl2+4H2O
FeO+2HCl═FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3 ⑤C
【实施实验】
目的:确定固体X的组成.
| 步骤 | 操作 | 主要现象 | 结论 |
| Ⅰ | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| Ⅱ | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C |
| Ⅲ | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 |
| Ⅳ | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生气泡. | 一定有Fe |
| Ⅴ | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 | 操作 | 数据 |
| Ⅰ | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| Ⅱ | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3.g |
| Ⅲ | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X的成分及质量分别是C是1.1g,Fe是16.8g.
9.下列实验操作正确的是( )
| A. |  滴加液体 | B. |  取用固体 | C. |  给液体加热 给液体加热 | D. |  过滤 |
6.利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、试剂瓶 | 用固体氯化钠配制一定溶质质量分数的溶液 |
| D | 锥形瓶、水槽、集气瓶、导管、分液漏斗 | 用双氧水和二氧化锰制取并收集氧气 |
| A. | A | B. | B | C. | C | D. | D |
 ,请回答下列问题:
,请回答下列问题: