题目内容
8.大理石的主要成份是CaCO3;试计算CaCO3中钙元素和氧元素的质量比5:6;CaCO3中钙元素的质量分数是40%.
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
解答 解:(1)碳酸钙中钙、氧两种元素的质量比为40:(16×3)=5:6.
(2)碳酸钙中钙元素的质量分数为$\frac{40}{40+12+16×3}×$100%=40%.
故答案为:5:6;40%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
6.石灰石样品的主要成分是碳酸钙(已知其他杂质不与盐酸反应),课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象: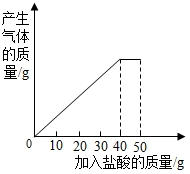
请计算:
(1)完全反应后产生二氧化碳的质量;
(2)石灰石样品中CaCO3的纯度.

| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
(1)完全反应后产生二氧化碳的质量;
(2)石灰石样品中CaCO3的纯度.
20.制备卤磷酸钙萤光粉所用的原料氯化钙中混有氯化镁,除去的方法是把原料氯化钙的水溶液加热到90℃~95℃,在不断搅拌下加入适当的沉淀剂,使镁离子生成沉淀,过滤除去.此沉淀剂最好选用( )
| A. | 氢氧化钙乳浆 | B. | 碳酸钠溶液 | C. | 氯化钠溶液 | D. | 氢氧化钠溶液 |
 我县一所初中的化学兴趣小组的同学利用如图所示装置进行利用分解高锰酸钾制取氧
我县一所初中的化学兴趣小组的同学利用如图所示装置进行利用分解高锰酸钾制取氧 已知A和C的组成元素相同,C在二氧化锰的催化下可以得到可以供给呼吸的气体B和A.固体D在纯净的B中剧烈燃烧,火星四射,生成黑色固体E.回答下列问题
已知A和C的组成元素相同,C在二氧化锰的催化下可以得到可以供给呼吸的气体B和A.固体D在纯净的B中剧烈燃烧,火星四射,生成黑色固体E.回答下列问题 如图是实验室电解水装置示意图,据图回答
如图是实验室电解水装置示意图,据图回答