题目内容
16. 海洋中含有十三亿五千多万立方千米的水,约占地球上总水量的97%.海水是名副其实的液体矿藏,平均每立方公里的海水中有3570万吨的矿物质,世界上已知的100多种元素中,80%可以在海水中找到.如图为海水中溶解的盐分表.海水还是陆地上淡水的来源和气候的调节器,世界海上每年蒸发的淡水有450万立方公里,其中90%通过降雨返回海洋,10%变为雨雪落在大地上,然后顺河流又返回海洋.海水淡化技术正在发展成为产业.有人预计,随着生态环境的恶化,人类解决水荒的最后途径很可能是对海水的淡化.
海洋中含有十三亿五千多万立方千米的水,约占地球上总水量的97%.海水是名副其实的液体矿藏,平均每立方公里的海水中有3570万吨的矿物质,世界上已知的100多种元素中,80%可以在海水中找到.如图为海水中溶解的盐分表.海水还是陆地上淡水的来源和气候的调节器,世界海上每年蒸发的淡水有450万立方公里,其中90%通过降雨返回海洋,10%变为雨雪落在大地上,然后顺河流又返回海洋.海水淡化技术正在发展成为产业.有人预计,随着生态环境的恶化,人类解决水荒的最后途径很可能是对海水的淡化.(1)海水属于混合物(填“纯净物”或“混合物”).
(2)蒸发一定量海水后得到的固体物质中含量最多的物质是NaCl.(用化学符号表示).
(3)从雨雪的形成过程分析,雨水属于软水(填“硬水”或“软水”).生活中可用肥皂水区别硬水与软水.
(4)下列有关海水的说法正确的是ABD.
A、海水中含有丰富的矿藏资源 B、海水淡化将可能解决淡水危机
C、海水中含量最多的物质是氯化钠 D、海水在调节陆地气候中起着重要的作用
E、直接饮用海水可摄入人体所需要的多种元素.
分析 (1)海水中含有多种物质,属于混合物;
(2)海水中钠离子和氯离子含量较高,因此蒸发一定量海水后得到的固体物质中含量最多的物质是氯化钠;
(3)雨雪是海水蒸发形成的,雨水中不含有镁离子、钙离子,属于软水;
利用肥皂水可以区分硬水和软水;
(4)A、海水中含有丰富的矿藏资源;
B、海水淡化将可能解决淡水危机;
C、海水中含量最多的物质是水;
D、海水在调节陆地气候中起着重要的作用;
E、海水中含有多种矿物质,不能直接饮用.
解答 解:(1)海水含有多种物质,属于混合物.
故填:混合物.
(2)蒸发一定量海水后得到的固体物质中含量最多的物质是.
(3)雨雪是海水蒸发形成的,雨水中不含有镁离子、钙离子,属于软水;
向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生大量浮渣,是硬水,因此生活中可用肥皂水区别硬水与软水.
故填:软水;肥皂水.
(4)A、海水中含有丰富的矿藏资源,该选项说法正确;
B、海水淡化将可能解决淡水危机,该选项说法正确;
C、海水中含量最多的物质是水,该选项说法不正确;
D、海水在调节陆地气候中起着重要的作用,该选项说法正确;
E、海水中含有多种矿物质,不能直接饮用,该选项说法不正确.
故填:ABD.
点评 化学来源于生产、生活,也服务于生产、生活,要学好化学知识,为生产、生活服务.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20.某化合物在空气中燃烧的化学反应方程式为:2X+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O根据质量守恒定律,可推断出X的化学式为( )
| A. | C2H4 | B. | C2H2 | C. | CH4 | D. | CH4O |
1.下列有关硫酸铜的性质中,属于化学性质的是( )
①.硫酸铜晶体能溶于水 ②.硫酸铜晶体呈蓝色 ③.硫酸铜晶体受热时会从蓝色变为白色 ④.在硫酸铜溶液中滴加氢氧化钠溶液会产生蓝色沉淀.
①.硫酸铜晶体能溶于水 ②.硫酸铜晶体呈蓝色 ③.硫酸铜晶体受热时会从蓝色变为白色 ④.在硫酸铜溶液中滴加氢氧化钠溶液会产生蓝色沉淀.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
4.浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔.
(1)工业上利用太阳能进行海水晒盐.已知海水蒸发浓缩过程中析出盐的种类和质量如右表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
①海水从密度为1.21g/ml浓缩到1.22g/ml时下列说法正确的是C
A.各种盐的溶解度增大 B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是硫酸钙.
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如图:

已知:ⅰ常温下,NH3极易溶于水,CO2能溶于水;
ⅱNaHCO3加热易分解,Na2CO3加热不易分解.
完成下列填空:
①粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为Mg(OH)2、CaCO3;
②流程中,先“氨化”后“碳酸化”的目的是氨盐水显碱性,更容易吸收二氧化碳;
③“碳酸化”后过滤获得的NH4Cl可用作氮肥,也可先加热(填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是氨气;
④“煅烧”时,NaHCO3分解生成的气体D是二氧化碳,若将气体D直接排入空气不合理的理由是导致温室效应.
(3)海滨研究所以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1: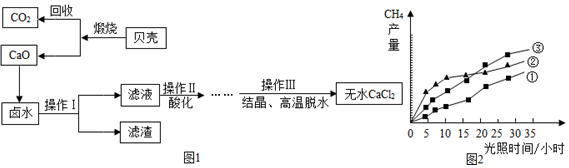
请回答下列问题:
①操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2.
③操作Ⅱ酸化时应选择的酸是HCl(填写化学式).
④上述反应中未涉及的基本反应类型是b(填写字母).
a.复分解反应 b.置换反应 c.化合反应 d.分解反应
⑤回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为CO2+2H2O$\frac{\underline{\;催化剂\;}}{紫外线}$CH4+2O2.紫外线照射时,在不同催化剂(①、②、③)的作用下,甲烷产量随光照时间的变化如图2所示,在第10小时时甲烷产量最高是②(填写“①”、“②”、或“③”).
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
①海水从密度为1.21g/ml浓缩到1.22g/ml时下列说法正确的是C
A.各种盐的溶解度增大 B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是硫酸钙.
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如图:

已知:ⅰ常温下,NH3极易溶于水,CO2能溶于水;
ⅱNaHCO3加热易分解,Na2CO3加热不易分解.
完成下列填空:
①粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为Mg(OH)2、CaCO3;
②流程中,先“氨化”后“碳酸化”的目的是氨盐水显碱性,更容易吸收二氧化碳;
③“碳酸化”后过滤获得的NH4Cl可用作氮肥,也可先加热(填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是氨气;
④“煅烧”时,NaHCO3分解生成的气体D是二氧化碳,若将气体D直接排入空气不合理的理由是导致温室效应.
(3)海滨研究所以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:

请回答下列问题:
①操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2.
③操作Ⅱ酸化时应选择的酸是HCl(填写化学式).
④上述反应中未涉及的基本反应类型是b(填写字母).
a.复分解反应 b.置换反应 c.化合反应 d.分解反应
⑤回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为CO2+2H2O$\frac{\underline{\;催化剂\;}}{紫外线}$CH4+2O2.紫外线照射时,在不同催化剂(①、②、③)的作用下,甲烷产量随光照时间的变化如图2所示,在第10小时时甲烷产量最高是②(填写“①”、“②”、或“③”).
6.有一包白色粉末,可能由氯化钠、硫酸钠、硫酸铜、碳酸钠、碳酸钙中的一种或几种组成,为确定其组成,进行如下实验.
①称取一定质量的该白色粉末加足水量溶解,得无色溶液A.
②在无色溶液A中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液B和白色沉淀C;将白色沉淀C洗涤、烘干后称得质量为10g.
③在10g白色沉淀C中加入足量的稀硝酸,沉淀部分消失,并由气泡冒出.
④在无色溶液B中滴加硝酸银溶液和稀硝酸,产生白色沉淀
由上述实验得出的下列判断中,正确的是( )
①称取一定质量的该白色粉末加足水量溶解,得无色溶液A.
②在无色溶液A中加入过量氯化钡溶液,充分反应后过滤,分别得无色溶液B和白色沉淀C;将白色沉淀C洗涤、烘干后称得质量为10g.
③在10g白色沉淀C中加入足量的稀硝酸,沉淀部分消失,并由气泡冒出.
④在无色溶液B中滴加硝酸银溶液和稀硝酸,产生白色沉淀
由上述实验得出的下列判断中,正确的是( )
| A. | 白色粉末中可能含有氯化钠 | |
| B. | 无色溶液B中可能含有两种溶质 | |
| C. | 白色粉末中不含碳酸钙、硫酸钠、硫酸铜 | |
| D. | 步骤③生成的气体质量可能是2.2g |
 如图为实验室制取并收集一定体积气体(或测量生成气体体积)为分液漏斗图的实验装置图.
如图为实验室制取并收集一定体积气体(或测量生成气体体积)为分液漏斗图的实验装置图. 某化学兴趣小组同学设计了如图所示的装置,请根据所学知识回答有关问题:
某化学兴趣小组同学设计了如图所示的装置,请根据所学知识回答有关问题:


 实验室用一定质量的氯酸钾和二氧化锰制取氧气,回答下列问题.
实验室用一定质量的氯酸钾和二氧化锰制取氧气,回答下列问题.