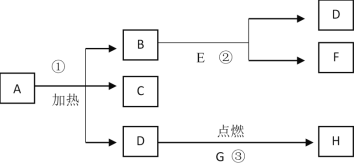
题目内容
【题目】小丽同学取铜和氧化铜的混合物m g置于烧杯中,并向烧杯中逐滴加入稀硫酸溶液,不断搅拌,测得烧杯中溶液的质量与加入稀硫酸的质量关系如图所示。求:

(1)m g混合物中,氧化铜的质量是_______克;
(2)当加入51.6g稀硫酸溶液时恰好完全反应,此时溶液中溶质的质量分数。
【答案】(1)8.4g(2)28%
【解析】
(1)铜与稀硫酸不反应,氧化铜可与稀硫酸反应生成硫酸铜和水。所以溶液质量的增加值60g-51.6g=8.4g,即混合物中氧化铜的质量。
(2)已知氧化铜的质量,要求反应后溶质(硫酸铜)的质量。可根据二者在化学方程式中的质量关系进行求解。具体解题过程:
解:设生成硫酸铜的质量为x 设未知量
CuO+H2SO4=CuSO4+H2O 写出反应的化学方程式
80 160 标出已知未知量的质量关系
8.4g x 标出已知未知量
80:160=8.4g:x 根据标出的量列比例式
x=16.8g 求解未知量
当恰好完全反应时,溶液中溶质的质量分数为:
16.8g÷60g×100%
=28%
答:溶液中溶质的质量分数为28%

【题目】醉驾是危险驾驶罪,常用重铬酸钾(K2Cr2O7)在酸性环境下与乙醇反应来检测司机是否大量饮酒,该反应的化学方程式为2K2Cr2O7+3C2H5OH+8H2SO4=3CH3COOH+2K 2SO4+2Cr2(SO4) 3+11H2O。已知:
CH3COOH | K2Cr2O7 | Cr(OH)3 | K2CrO4 | Cr2(SO4)3 |
无色 | 橙红色 | 灰蓝色 | 黄色 | 蓝紫色 |
易溶于水 | 易溶于水 | 难溶于水 | 易溶于水 | 易溶于水 |
(1)白酒中的溶质乙醇属于____(填“有机物”或“无机物”)。
(2)重铬酸钾酸性溶液检测出司机大量饮酒的现象是____。
(3)硫酸铬[Cr2(SO4)3]溶液与氢氧化钠溶液能发生复分解反应的原因是___,该反应的化学方程式为_____。