题目内容
2.已知:镁在空气中燃烧生成氧化镁和氮化镁(Mg3N2),氮化镁与水反应生成氢氧化镁和氨气.(1)写出氮化镁与水反应的化学方程式Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(2)a 克镁在空气中完全燃烧生成固体的总质量m为$\frac{25a}{18}$<m<$\frac{5a}{3}$(用含a 的式子表示m 的取值范围);
(3)某学生对该混合物中氮化镁的质量分数进行测定,设计如下实验装置.
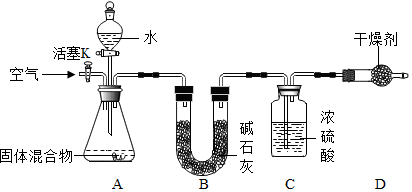
【查阅资料】Ⅰ.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与NH3 反应.
Ⅱ.2NH3+H2SO4=(NH4)2SO4
Ⅲ.NH3 是一种极易溶于水的气体.
【实验步骤】①检查装置的气密性;②精确称量镁在空气中燃烧后的固体5.00g 放入锥形瓶中,称量装置C,连接好装置;③关闭活塞K,打开A 中分液漏斗活塞,逐滴加入水,至样品恰好完全反应;④打开活塞K,鼓入空气;⑤再次称量装置C,装置C 增重0.34g.
请回答:
(一)装置B 的作用是吸收水蒸气;
(二)装置D 的作用是防止空气中的水蒸气进入C装置中;
(三)实验步骤④中鼓入空气的目的是使生成的氨气完全被浓硫酸吸收;
(四)固体混合物中Mg3N2的质量分数为20%;
(五)实验证明此方法测定的结果偏低,可能原因是部分氨气溶于水中(写一条).
分析 根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
根据提供的数据可以进行相关方面的计算;
碱石灰能够吸收水蒸气和二氧化碳.
解答 解:(1)氮化镁与水反应的化学方程式为:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(2)设ag镁和氧气反应生成的氧化镁的质量为x,ag镁和氮气反应生成氮化镁的质量为y,
2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2,
48 80 72 100
ag x ag y
$\frac{48}{ag}=\frac{80}{x}$,$\frac{72}{ag}=\frac{100}{y}$,
x=$\frac{5a}{3}$g,y=$\frac{25a}{18}$g,
因此ag镁在空气中完全燃烧生成固体的总质量m为:$\frac{25a}{18}$<m<$\frac{5a}{3}$;
(一)装置B的作用是吸收水蒸气;
(二)装置D的作用是防止空气中的水蒸气进入C装置中;
(三)实验步骤④中鼓入空气的目的是使生成的氨气完全被浓硫酸吸收;
(四)设氮化镁的质量为z,
装置C增重0.34g,说明生成了0.34g氨气,
Mg3N2+6H2O═3Mg(OH)2+2NH3↑,
100 34
z 0.34g
$\frac{100}{z}=\frac{34}{0.34g}$,
z=1g,
固体混合物中Mg3N2的质量分数为:$\frac{1g}{5g}$×100%=20%;
(五)实验证明此方法测定的结果偏低,可能原因是部分氨气溶于水中.
故填:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;$\frac{25a}{18}$<m<$\frac{5a}{3}$;吸收水蒸气;防止空气中的水蒸气进入C装置中;使生成的氨气完全被浓硫酸吸收;20%;部分氨气溶于水中.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. |  制取蒸馏水 制取蒸馏水 | B. |  稀释浓硫酸 | ||
| C. |  测溶液的pH | D. |  称取氢氧化钠固体 |
 医生给病人输液时,常用葡萄糖注射液或氯化钠注射液,有时根据病情,也可用葡萄糖复化钠注射液.如图所示的是这种注射液的部分标签.
医生给病人输液时,常用葡萄糖注射液或氯化钠注射液,有时根据病情,也可用葡萄糖复化钠注射液.如图所示的是这种注射液的部分标签.