题目内容
20.学校化学兴趣小组为测定某赤铁矿石(含Fe2O3和杂质,杂质不溶于水且不参加化学反应)中Fe2O3的质量分数,他们称取20g矿石于烧杯中,然后加入84g稀盐酸,恰好完全反应,过滤,得到滤渣4g.求:(1)赤铁矿石中Fe2O3的质量分数;
(2)滤液中溶质的质量分数.
(注:有关化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O)
分析 赤铁矿与盐酸混合,铁矿中氧化铁和盐酸反应,得到氯化铁溶液,铁矿中杂质既不溶酸,也不溶于水,形成滤渣.所以,铁矿中氧化铁的质量为20g-4g=16g,利用氧化铁的质量求出生成的氯化铁的质量进而求出所得滤液中溶质的质量分数即可.
解答 解:(1)赤铁矿样品中Fe2O3的质量=20g-4g=16g;故赤铁矿样品中Fe2O3的质量分数(纯度)=$\frac{16g}{20g}$×100%=80%.
(2)设反应后生成氯化铁的质量为x.
Fe2O3+6HCl=2FeCl3+3H2O
160 325
16g x
$\frac{160}{325}=\frac{16g}{x}$,解之得 x=32.5g
反应后所得溶液质量=20g+84g-4g=100g,故反应后所得溶液中溶质的质量分数=$\frac{32.5g}{100g}$×100%=32.5%.
故答案为:(1)80%;(2)32.5%.
点评 本题主要考虑反应后溶液质量可根据质量守恒进行计算:反应后溶液质量=赤铁矿质量+稀盐酸质量-滤渣质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.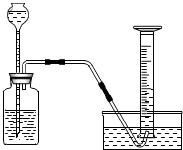 在学习了“金属的化学性质”后,小吴同学进行了如下探究:
在学习了“金属的化学性质”后,小吴同学进行了如下探究:
【实验目的】比较甲、乙两种金属的活动性强弱和相对原子质量大小.
【实验装置】如图
【实验步骤】取两种纯金属各m克,分别加入足量的相同稀硫酸进行反应,在相同条件下测定不同时间内收集到的气体体积.
【实验数据】
【实验分析】
(1)由实验结果可知:金属活动性较强的是乙.
(2)为了使得到的实验数据准确,小吴开始收集气体的时间点应该是A.
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时
(3)根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道AB.
A.这种条件下,氢气的密度 B.生成物中金属元素的化合价
【实验反思】
(1)实验中,小吴认为两种金属除质量必须相同外,金属还需要满足的条件是形状(或表面积)要相同.
(2)实验中,小吴认为实验结束时收集的氢气体积一定比理论值要大,原因是滴下的稀硫酸也占有一定的体积(其他合理答案也可以).
 在学习了“金属的化学性质”后,小吴同学进行了如下探究:
在学习了“金属的化学性质”后,小吴同学进行了如下探究:【实验目的】比较甲、乙两种金属的活动性强弱和相对原子质量大小.
【实验装置】如图
【实验步骤】取两种纯金属各m克,分别加入足量的相同稀硫酸进行反应,在相同条件下测定不同时间内收集到的气体体积.
【实验数据】
| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
(1)由实验结果可知:金属活动性较强的是乙.
(2)为了使得到的实验数据准确,小吴开始收集气体的时间点应该是A.
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时
(3)根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道AB.
A.这种条件下,氢气的密度 B.生成物中金属元素的化合价
【实验反思】
(1)实验中,小吴认为两种金属除质量必须相同外,金属还需要满足的条件是形状(或表面积)要相同.
(2)实验中,小吴认为实验结束时收集的氢气体积一定比理论值要大,原因是滴下的稀硫酸也占有一定的体积(其他合理答案也可以).