题目内容
现有225克20%的NaNO3溶液,若在此溶液中:
①加入225克水,溶液中溶质的质量分数为 ;
②蒸发112.5克水,溶液中溶质的质量分数为 ;
③加入75克NaNO3晶体后,溶液中溶质的质量分数为 ;
④加入5克NaNO3晶体和170克水后,溶液中溶质的质量分数为 ;
⑤加入45克NaNO3晶体再蒸发45克水后,溶液中溶质的质量分数为 ;
⑥加入50克20%的NaNO3溶液后,溶液中溶质的质量分数为 .
①加入225克水,溶液中溶质的质量分数为
②蒸发112.5克水,溶液中溶质的质量分数为
③加入75克NaNO3晶体后,溶液中溶质的质量分数为
④加入5克NaNO3晶体和170克水后,溶液中溶质的质量分数为
⑤加入45克NaNO3晶体再蒸发45克水后,溶液中溶质的质量分数为
⑥加入50克20%的NaNO3溶液后,溶液中溶质的质量分数为
考点:有关溶质质量分数的简单计算
专题:溶液的组成及溶质质量分数的计算
分析:溶液中溶质的质量分数=
×100%,则溶质的质量=溶液质量×溶液中溶质的质量分数.
| 溶质质量 |
| 溶液质量 |
解答:解:由于溶质的质量分数═
×100%,则225g质量分数为20%的NaNO3溶液里溶质的质量为:225g×20%=45g.
①由于在该溶液中加入225克水后,溶质的质量并没有发生变化,故所得溶液中溶质的质量分数为:
×100%=10%.
②蒸发112.5克水,溶质的质量并没有发生变化,故所得溶液中溶质的质量分数为:
×100%=40%.
③加入75克NaNO3晶体后,溶质、溶液的质量均增加,故所得溶液中溶质的质量分数为
×100%=40%.
④加入5克NaNO3晶体和170克水后,溶质、溶液的质量均增加,故所得溶液中溶质的质量分数为
×100%=12.5%.
⑤加入45克NaNO3晶体再蒸发45克水后,增加溶质的质量和蒸发溶剂的质量相等,所以溶质的质量增加、溶液的质量不变,故所得溶液中溶质的质量分数为
×100%=40%.
⑥加入50克的NaNO3溶液后,溶液中溶质的质量分数为
×100%=20%.
故答案为:①10%;②40%;③40%;④12.5%;⑤40%;⑥20%.
| 溶质质量 |
| 溶液质量 |
①由于在该溶液中加入225克水后,溶质的质量并没有发生变化,故所得溶液中溶质的质量分数为:
| 45g |
| 225g+225g |
②蒸发112.5克水,溶质的质量并没有发生变化,故所得溶液中溶质的质量分数为:
| 45g |
| 225g-112.5g |
③加入75克NaNO3晶体后,溶质、溶液的质量均增加,故所得溶液中溶质的质量分数为
| 45g+75g |
| 225g+75g |
④加入5克NaNO3晶体和170克水后,溶质、溶液的质量均增加,故所得溶液中溶质的质量分数为
| 45g+5g |
| 225g+5g+170g |
⑤加入45克NaNO3晶体再蒸发45克水后,增加溶质的质量和蒸发溶剂的质量相等,所以溶质的质量增加、溶液的质量不变,故所得溶液中溶质的质量分数为
| 45g+45g |
| 225g |
⑥加入50克的NaNO3溶液后,溶液中溶质的质量分数为
| 45g+50g×20% |
| 225g+50g |
故答案为:①10%;②40%;③40%;④12.5%;⑤40%;⑥20%.
点评:本题的难度不是很大,主要考查了有关溶质的质量分数的有关计算及用水稀释溶液的有关计算,加深学生对溶质质量分数的理解,从而培养学生解决问题的能力和计算能力.

练习册系列答案
相关题目
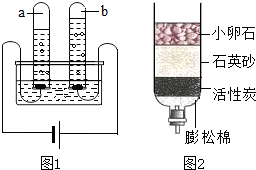



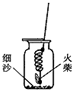 做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与.
做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与.