题目内容
6.为探究Fe、Cu、Ag的金属活动性强弱,某兴趣小组做了如下实验: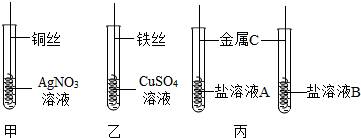
(1)实验前需将金属丝打磨,目的是除去金属表面的氧化膜.
(2)甲实验中发生反应的化学方程式为Cu+2AgNO3═2Ag+Cu(NO3)2;乙实验中观察到的现象为铁丝的表面有一层红色物质,溶液由蓝色逐渐变为浅绿色.
(3)通过甲、乙实验探究,可得出三种金属活动性由强到弱的顺序为Fe>Cu>Ag.
(4)若采用丙实验方案也可得出相同结论,则金属C是Cu.
分析 在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,利用这一规律对问题进行判断分析即可.
解答 解:(1)实验前需将金属丝打磨,目的是除去金属表面的氧化膜.
(2)甲实验中铜能置换出硝酸银中的银,同时生成硝酸铜,发生反应的化学方程式为:Cu+2AgNO3═2Ag+Cu(NO3)2;乙实验中铁能置换出铜,同时生成了硫酸亚铁,观察到的现象为:铁丝的表面有一层红色物质,溶液由蓝色逐渐变为浅绿色.
(3)通过甲、乙实验探究,可得出三种金属活动性由强到弱的顺序为:Fe>Cu>Ag.
(4)由丙实验方案可知,若采用一种金属与两种盐溶液反应来比较三种金属的活动性强弱,可以采用活动性居中的金属与两种盐溶液反应,也可得出相同结论,则金属C是Cu.
故答为:(1)除去金属表面的氧化膜;(2)Cu+2AgNO3═2Ag+Cu(NO3)2;铁丝的表面有一层红色物质,溶液由蓝色逐渐变为浅绿色.(3)Fe>Cu>Ag.(4)Cu.
点评 同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.验证三种金属活动性顺序类问题时,一般采取“三取中”的方法进行设计实验,即选取活动性位于中间的那种金属的单质与另两种金属的盐溶液反应;或取中间金属的盐溶液与另两种金属的单质进行反应.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
17.鉴别CO2、O2、H2、空气四种气体,最简便的方法是( )
| A. | 分别测密度 | B. | 用澄清石灰水区别 | ||
| C. | 用带火星的木条区别 | D. | 用燃着的木条区别 |
11.某纯净物X燃烧的化学方程式为:X+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,则X的化学式是( )
| A. | CH20 | B. | C2H4 | C. | CH4O | D. | CH4 |
18.我们每天都生活在一个不断变化的物质世界里.下列变化一定属于化学变化的是( )
| A. | 久置在空气中的澄清石灰水表面产生一层白膜 | |
| B. | 爆炸 | |
| C. | 伴随有发光、放热现象的变化 | |
| D. | 用干冰做制冷剂进行人工降雨 |
15.美国普度大学研发出一种制备氢气的新工艺,流程如图所示.下列说法错误的是( )


| A. | 铝镓合金可以循环使用 | |
| B. | 太阳能的利用可以部分解决能源危机问题 | |
| C. | 铝镓合金与水反应的化学方程式为:2Al+3H2O$\frac{\underline{\;一定条件\;}}{\;}$Al2O3+3H2↑ | |
| D. | 流程中的氧化铝、水和氧气都属于氧化物 |
 A~G是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作建筑材料,G是红棕色固体,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去)
A~G是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作建筑材料,G是红棕色固体,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去) 如图为某钙片的商品标签,根据标签的有关信息,某儿童按标签用量服药,每天补充钙元素质量是0.6g.
如图为某钙片的商品标签,根据标签的有关信息,某儿童按标签用量服药,每天补充钙元素质量是0.6g.