题目内容
14. 质量守恒定律的定量研究对化学科学发展具有重大作用.
质量守恒定律的定量研究对化学科学发展具有重大作用.(1)硝酸在工业生产中有广泛的应用,工业上制取硝酸的关键反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6R,其中R的化学式为H2O;
(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”、“>”或“<”)m1=m2;
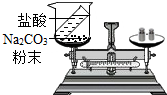
(3)如图所示装置,将烧杯放在天平上用砝码平衡,然后倾斜烧 杯使盐酸与碳酸钠粉末接触,一段时间后再把烧杯放在天平上称量,发现天平的指针偏右,其原因是盐酸与碳酸钠粉末反应的装置不密闭,生成二氧化碳气体逸出,使左盘内质量减小,由这个实验推测:要验证质量守恒定律,有气体生成时,实验环境应在密闭(开放、密闭)体系中进行.
分析 (1)根据质量守恒定律进行分析判断.
(2)反应中没有气体参加,所以放在敞口的烧杯中进行实验,反应前后烧杯内物质质量也不变.
(3)根据用实验来验证质量守恒定律,那么结果不外乎两个:相等(当没有气体参加或不生成气体时)、不相等 (当有气体参加或生成气体时)解答.
解答 解:(1)依据化学反应前后原子的种类、数目不发生改变:N原子前后均为4,故R中无N原子;反应前有12个H原子,而NO中无H原子,故“6R”中有12个H原子,每个R中有2个H原子;同理可得每个R中含1个O原子,即化学式为:H2O
(2)因为反应过程中没有气体放出,所以反应前后烧杯中物质质量相等.
(3)造成天平的指针向右偏转的原因是:盐酸与碳酸钠粉末反应的装置不密闭,生成二氧化碳气体逸出,使左盘内质量减小;要验证质量守恒定律,有气体生成时,实验环境应在密闭体系中进行.
故答案为:(1)H2O;(2)=;(3)盐酸与碳酸钠粉末反应的装置不密闭,生成二氧化碳气体逸出,使左盘内质量减小;密闭.
点评 在任何与周围隔绝的体系中,不论发生何种变化或过程,其总质量始终保持不变.

练习册系列答案
相关题目
5.下列说法错误的是( )
| A. | 钠原子和钠离子具有相同的质子数 | |
| B. | 洗洁精能洗去油污是因为它能溶解油污 | |
| C. | 酸碱中和后溶液不一定呈中性 | |
| D. | 有发热、发光现象的不一定是燃烧 |
2. 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
【提出问题】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别做了实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是(2)加入稀盐酸有气泡只能证明有碳酸钙,不能证明有无氢氧化钙;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】丙同学:KOH、K2CO3丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了(3)丁同学猜想正确,理由是(4)固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为(5)K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
 据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:【提出问题】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别做了实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加(1)酚酞试液 | 溶液由无色变为红色 | 自己的猜想正确 |
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】丙同学:KOH、K2CO3丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了(3)丁同学猜想正确,理由是(4)固体中含有氢氧化钙,说明溶液中的碳酸钾已完全反应.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为(5)K2CO3+Ca(OH)2═CaCO3↓+2KOH,小组同学通过相应的实验操作最终制得了氢氧化钾.
9.如图所示的四个图象,能正确反映对应变化关系的是( )
| A. |  水的电解 | B. |  木炭在密闭容器中燃烧 | ||
| C. |  加热一定量的高锰酸钾制氧气 | D. |  过量红磷测定空气中氧气含量 |
19.如图图示的化学实验基本操作中,正确的是( )
| A. |  读取液体体积 | B. |  检验气密性 | C. |  加热液体 | D. |  添加酒精 |
6. 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
【查阅资料】
Ⅰ.碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
Ⅱ.碳酸钠溶液呈碱性.
【进行实验】为了验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠(或水雾等).
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是量守恒定律(或化学反应前后元素种类不变或化学反应前后原子种类不变或NaHCO3中含有Na、H、C、O元素).
②兴趣小组为了确定反应后的固体产物成分进行以下实验,请填写如表:
【讨论与评价】实验一的结论与实验二、实验三的结论相反,在讨论时兴趣小组的同学认为方案一的结论不正确,他们的理由是碳酸钠溶液呈碱性,也能使无色酚酞变成红色.
【总结】请写出碳酸氢钠受热分解的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质),取样品10.0g逐滴加入稀盐酸,所得气体的质量为4.4g.
求:样品中碳酸氢钠的质量分数.
 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.【查阅资料】
Ⅰ.碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
Ⅱ.碳酸钠溶液呈碱性.
【进行实验】为了验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠(或水雾等).
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3.
①他们的依据是量守恒定律(或化学反应前后元素种类不变或化学反应前后原子种类不变或NaHCO3中含有Na、H、C、O元素).
②兴趣小组为了确定反应后的固体产物成分进行以下实验,请填写如表:
| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH, 而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3, 而不是NaOH |
| 实验三:取少量反应后的固体产物,加入过量稀盐酸(或稀硫酸、稀硝酸、醋酸) | 产生大量气泡 | 固体产物是Na2CO3, 而不是NaOH |
【总结】请写出碳酸氢钠受热分解的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质),取样品10.0g逐滴加入稀盐酸,所得气体的质量为4.4g.
求:样品中碳酸氢钠的质量分数.
3.在一定条件下,甲乙丙丁四种物质在一密闭容器内充分反应.测得反应前后各物质的质量如下表所示,回答以下问题:
(1)m的值为1;该反应的基本类型是化合反应
(2)参加反应的乙、丁的质量比是3:2
(3)若乙、丙的摩尔质量之比为3:2,则两者的化学计量数之比为2:5.
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 1 | 20 | 15 | 8 |
| 反应后质量/g | m | 11 | 30 | 2 |
(2)参加反应的乙、丁的质量比是3:2
(3)若乙、丙的摩尔质量之比为3:2,则两者的化学计量数之比为2:5.
 不少同学都被蚊虫叮咬过,感觉又痛又痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤.课外兴趣小组同学决定对其进行探究.
不少同学都被蚊虫叮咬过,感觉又痛又痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤.课外兴趣小组同学决定对其进行探究.