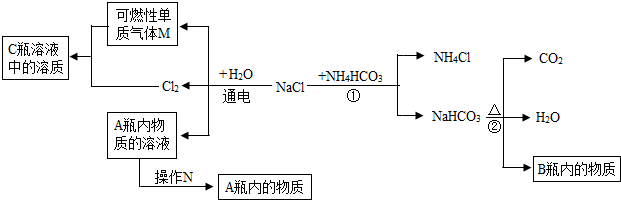
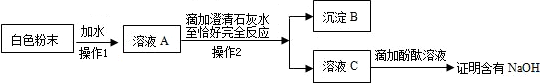
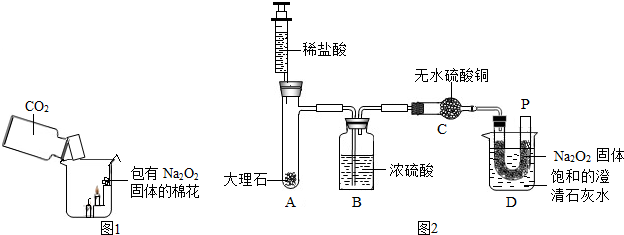
题目内容
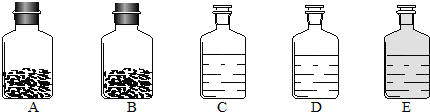
如图中表示可燃物能燃烧的点是( )

| A.a | B.b | C.c | D.d |

根据燃烧需要同时满足三个条件:①可燃物 ②氧气或空气 ③达到燃烧所需的最低温度即着火点,
由图可知:a点温度在着火点以上,没有氧气参加,故不能燃烧;
b点温度达到着火点,但没有氧气参与,故不会燃烧;
c点温度没达到着火点,虽然有氧气参与,但不会燃烧;
d点有氧气参与,温度达到着火点,故会燃烧.
故选D.
由图可知:a点温度在着火点以上,没有氧气参加,故不能燃烧;
b点温度达到着火点,但没有氧气参与,故不会燃烧;
c点温度没达到着火点,虽然有氧气参与,但不会燃烧;
d点有氧气参与,温度达到着火点,故会燃烧.
故选D.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目