题目内容
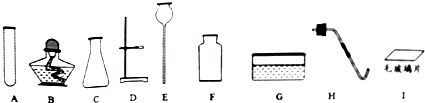
9.下列各组对比实验,不能达到实验目的是( )| 实验目的 | 实验方案 | ||
| 实验① | 实验② | ||
| A. | 探究Zn、Fe、Cu 的活动性强弱 |  |  |
| B. | 探究温度对反应剧烈程度的影响 |  |  |
| C. | 探究催化剂对反应快慢的影响 |  |  |
| D. | 探究CO2 的物理性质和化学性质 |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 锌比铁活泼,铁比铜活泼;
对比试验要确定好常量和变量;
二氧化碳密度比空气大,不能燃烧,不支持燃烧,能使澄清石灰水变浑浊.
解答 解:A、实验①中无明显现象,说明铁比铜活泼,实验②中锌表面附着一层黑色固体,说明锌比铁活泼,该选项能够达到实验目的;
B、实验②中比实验①中产生气泡多并且快,说明温度越高,反应速率越快,该选项能够达到实验目的;
C、由于温度不一样,因此无法比较催化剂对反应快慢的影响,该选项不能达到实验目的;
D、实验①中蜡烛由下而上依次熄灭,说明二氧化碳密度比空气大,不能燃烧,不支持燃烧,实验②中澄清石灰水变浑浊,说明二氧化碳能使澄清石灰水变浑浊,该选项能够达到实验目的.
故选:C.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.分类法是化学学习的重要方法.下列分类正确的是( )
| A. | 氧化物:H2O、C6H12O6 | B. | 金属元素:Hg、Pb | ||
| C. | 化合物:CO2、N2 | D. | 混合物:合金、冰水共存物 |
17.小勇同学对蛋壳的成分开展了有关探究,它的实验过程如下:①将一定量的蛋壳放入容器中;②往其中加入适量的稀盐酸,观察到有较多的气泡产生;③将生成的气体通入澄清石灰水中,观察到澄清石灰水变浑浊;④…最后得出结论--蛋壳的主要成分是碳酸钙.
(1)请补全第③步实验观察到的现象:澄清石灰水变浑浊;
(2)为了测定蛋壳中碳酸钙的质量分数,同学们用蛋壳与足量的稀盐酸充分反应,得到有关数据如下表:(CO2的密度为2克/升)
假设蛋壳中其它成分与稀盐酸反应后不生成CO2,试通过计算确定蛋壳中碳酸钙的质量分数.
(1)请补全第③步实验观察到的现象:澄清石灰水变浑浊;
(2)为了测定蛋壳中碳酸钙的质量分数,同学们用蛋壳与足量的稀盐酸充分反应,得到有关数据如下表:(CO2的密度为2克/升)
| 蛋壳的质量(克) | 加入稀盐酸的质量(克) | 收集到CO2的体积(升) |
| 8 | 150 | 1.1 |
14.金属冶炼就是要把金属从化合态变成游离态,使金属氧化物还原成金属单质,如图为有关实验室用一氧化碳还原氧化铜的实验装置,装置乙中的溶液为澄清石灰水,请回答与该实验有关的问题:

(1)实验时,从甲装置的玻璃管中观察到
的现象是黑色固体变成红色
(2)装置乙中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
关于这两组数据,下列说法不正确的是BD(选填相关的字母)
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.

(1)实验时,从甲装置的玻璃管中观察到
的现象是黑色固体变成红色
(2)装置乙中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
| 反应前 | 氧化铜完全反应后 | |
| Ⅰ组 | 洗气瓶和石灰水的质量为185g | 洗气瓶和瓶内物质的总质量为187g |
| Ⅱ组 | 玻璃管和氧化铜样品的质量为57.9g | 玻璃管和玻璃管内物质的质量为56.1g |
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.

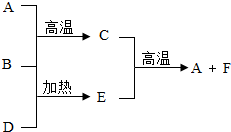 A是最常见的金属单质,B、D是常见的非金属单质,并且B和D反应,因B和D参于反应的相对量不同,可生成E或F.它们之间有RU 图所示的转化关系.
A是最常见的金属单质,B、D是常见的非金属单质,并且B和D反应,因B和D参于反应的相对量不同,可生成E或F.它们之间有RU 图所示的转化关系.