题目内容
9.从海水中提取镁的工业流程如图.请写出沉淀池中发生的主要反应的化学方程式Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2.在该工艺流程中化学反应未涉及的基本反应类型是置换反应.生产中循环使用的物质是氯气和氯化氢.
分析 根据反应流程图和物质间的化学反应进行分析,并依据无水MgCl2制取Mg的反应特点判断反应类型;根据反应物和生成物及其质量守恒定律可以正确书写化学方程式.
解答 解:提取镁的过程中,氢氧化钙与氯化镁的反应生成氢氧化镁沉淀和氯化钙;
在该工艺流程中水与生石灰反应生成氢氧化钙是化合反应,氢氧化镁与盐酸反应生成氯化镁和水是复分解反应,氯化镁通电分解成镁和氯气是分解反应.
没涉及的反应时置换反应,从整个实验流程看循环使用的物质是氯气和氯化氢;
故答案为:
Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2;置换; 氯气和氯化氢
点评 本题考查了海水制镁的原理和流程,根据反应流程从反应物和生成物上判断.

练习册系列答案
相关题目
19.常温下,饱和石灰水的pH约为11.3,现往一定量饱和石灰水中加入下列固体物质,恢复到常温时,溶液的pH一定不会发生改变的是( )
| A. | NaOH | B. | MgCl2 | C. | Na2CO3 | D. | CaO |
20.日常生活中的下列变化,其中一种与其余三种类别有本质区别的是( )
| A. | 食物腐败 | B. | 烟花爆炸 | C. | 铁生锈 | D. | 湿衣服晾干 |
4.某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
【查阅资料】
【实验探究】
(1)探究两者水溶液酸碱性的差异小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变红色,比较两种溶液的碱性强弱,可直接用pH试纸进行测定.
(2)验证两种粉末的稳定性在老师的指导下,该小组按图1装置进行实验操作,观察到乙(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,装置中棉花的作用是防止加热时小苏打粉末进入导管.
(3)测定食用纯碱粉末的纯度取食用纯碱粉末试样,利用图2装置进行实验测定.数据记录如下:
①反应生成CO2的质量为4.4g.
②通过计算确定食用纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数)

【查阅资料】
| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
(1)探究两者水溶液酸碱性的差异小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变红色,比较两种溶液的碱性强弱,可直接用pH试纸进行测定.
(2)验证两种粉末的稳定性在老师的指导下,该小组按图1装置进行实验操作,观察到乙(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,装置中棉花的作用是防止加热时小苏打粉末进入导管.
(3)测定食用纯碱粉末的纯度取食用纯碱粉末试样,利用图2装置进行实验测定.数据记录如下:
| 称量项目 | 称量时间 | 电子天平试样足量稀盐酸 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
②通过计算确定食用纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数)

1.空气是人类宝贵的自然资源.下列有关空气的说法正确的是( )
| A. | 分离空气得到的氮气常用作保护气 | |
| B. | 空气中的氧气约占空气总体积的五分之四 | |
| C. | 空气中的稀有气体不与任何物质发生反应 | |
| D. | 二氧化碳是造成酸雨的主要物质 |

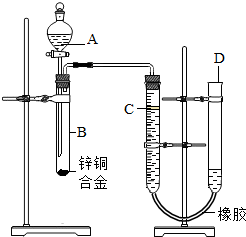 某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)  太阳能路灯系统是利用太阳能进行照明的装置,被越来越广泛地应用.它是由太阳能电池板、蓄电池、LED灯、灯柱、微电脑控制器这五大部分组成.
太阳能路灯系统是利用太阳能进行照明的装置,被越来越广泛地应用.它是由太阳能电池板、蓄电池、LED灯、灯柱、微电脑控制器这五大部分组成.