题目内容
11.某氯化钡样品23.1g中含有少量的氯化钠,某同学进行了如图所示的实验.请计算: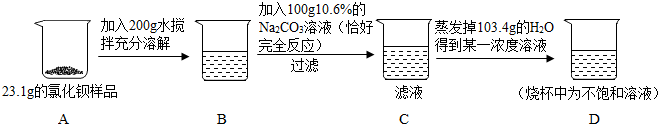
(1)过滤后得到沉淀多少克?
(2)原样品中氯化钡的质量分数?(计算结果精确到0.1%)
(3)求D烧杯中所得溶液的溶质质量分数是多少?
分析 (1)根据碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,依据碳酸钠的质量进行计算;
(2)根据化学方程式计算原混合物中氯化钡的质量,然后计算氯化钡的质量分数;
(3)根据题中的数据计算反应后,溶液D中溶质和溶液的质量,然后进行计算.
解答 解:(1)设生成碳酸钡沉淀的质量为x,生成氯化钠的质量为y,参加反应的氯化钡的质量为z
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 208 197 117
100g×10.6% z x y
$\frac{106}{100g×10.6%}$=$\frac{208}{z}$=$\frac{197}{x}$=$\frac{117}{y}$
x=19.7g
y=11.7g
z=20.8g
所以过滤后得到沉淀是19.7g;
(2)原样品中氯化钡的质量分数为:$\frac{20.8g}{23.1g}$×100%=90.0%;
(3)D烧杯中所得溶液的溶质质量分数是:$\frac{11.7g+23.1g-20.8g}{23.1g+200g+100g-19.7g-103.4g}$×100%=7%.
故答案为:(1)过滤后得到沉淀是19.7g;
(2)原样品中氯化钡的质量分数为90.0%;
(3)D烧杯中所得溶液的溶质质量分数是7%.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
11.观察和实验是学习化学的重要方式,下列实验现象描述正确的是( )
| A. | 木炭在氧气中燃烧发出白光 | |
| B. | 向硫酸铜溶液中滴入氯化钡溶液生成蓝色絮状沉淀 | |
| C. | 硫在氧气中燃烧发出淡蓝色火焰 | |
| D. | 向生石灰中加水,容器口上方出现大量白烟 |
3.每年的6月5日世界环境日,环境保护是我国的一项基本国策,空气的净化日益受到人们的关注.下列各种气体属于空气污染物的是( )
| A. | 二氧化碳 | B. | 一氧化碳 | C. | 氮气 | D. | 二氧化硫 |
1. 分子模型可以直观的表示分子的微观结构(分子模型中,不同颜色、大小的小球代表不同的原子).图所示的分子模型表示分子是( )
分子模型可以直观的表示分子的微观结构(分子模型中,不同颜色、大小的小球代表不同的原子).图所示的分子模型表示分子是( )
 分子模型可以直观的表示分子的微观结构(分子模型中,不同颜色、大小的小球代表不同的原子).图所示的分子模型表示分子是( )
分子模型可以直观的表示分子的微观结构(分子模型中,不同颜色、大小的小球代表不同的原子).图所示的分子模型表示分子是( )| A. | HCHO | B. | HSCN | C. | NH3 | D. | H2O2 |
 根据如图的装置图回答问题.
根据如图的装置图回答问题. 如图是一种可用于集气、洗气等的多功能装置
如图是一种可用于集气、洗气等的多功能装置
 A、B、C、D、E均为初中化学常见物质,各物质之间的关系如图所示,图中“-”表示相连的物质在一定条件下可以反应.“→”表示物质间存在转化关系.请回答以下问题.
A、B、C、D、E均为初中化学常见物质,各物质之间的关系如图所示,图中“-”表示相连的物质在一定条件下可以反应.“→”表示物质间存在转化关系.请回答以下问题.