题目内容
1. 如图是小宇同学对常见化合物的分类整理.
如图是小宇同学对常见化合物的分类整理.(1)甲处应填写的物质类型是氧化物;
(2)右图中遇水放热的是CaO,溶于水吸热的是NH4NO3.
(3)实验室现购进一批药品:烧碱、纯碱、熟石灰、生石灰、醋酸,其中应归为盐类的是Na2CO3 (写化学式),能改良酸性土壤的碱是Ca(OH)2(写化学式).
分析 物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐;由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.酸是电离出的阳离子全部是氢离子的化合物;碱是电离出的阴离子全部是氢氧根离子的化合物;盐是电离出金属离子和酸根离子的化合物.右图中遇水放热的是CaO,溶于水吸热的是NH4NO3;实验室现购进一批药品:烧碱、纯碱、熟石灰、生石灰、醋酸,其中应归为盐类的是Na2CO3;能改良酸性土壤的碱是Ca(OH)2.
解答 解:(1)纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐;故答案为:氧化物;
(2)右图中遇水放热的是CaO,溶于水吸热的是NH4NO3;故答案为:CaO,NH4NO3
(3)实验室现购进一批药品:烧碱、纯碱、熟石灰、生石灰、醋酸,其中应归为盐类的是Na2CO3;能改良酸性土壤的碱是Ca(OH)2;故答案为:Na2CO3、Ca(OH)2
点评 本考点考查了物质的分类和物质的性质,要加强记忆有关的知识点,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.

练习册系列答案
相关题目
9.下列各组物质间通过一步反应就能实现如图转化,则甲、乙、丙可能是( )


| A. | C CO CO2 | B. | CO2 C6H12O6 H2O | ||
| C. | CaO Ca(OH)2 CaCO3 | D. | Cu CuO Cu(OH)2 |
16.A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是( )


| A. | t1℃时,A的饱和溶液65 g中含有溶剂50 g | |
| B. | 将t2℃时A、B、C三种物质的饱和溶液降温至t1℃时,C溶液中溶质的质量分数保持不变 | |
| C. | 在t2℃时,A、B两种溶液中溶质的质量分数相同 | |
| D. | 除去A中少量的C,可采用降温结晶法 |
6.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入质量为m的Zn粉,充分反应后过滤,将滤渣洗涤、干燥后称量质量,得到固体的质量为m(不计损耗).由此判断下列说法中不正确的是( )
| A. | 取反应后的滤液观察,滤液可能呈蓝色 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,可能有气泡产生 | |
| D. | 滤渣中的物质至少有两种 |
10.在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
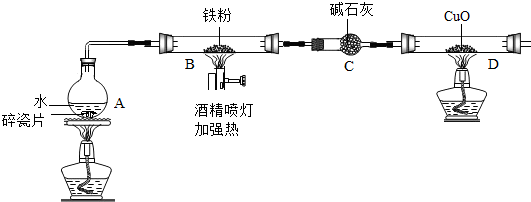
(1)【推断】观察到D中黑色固体变红,则B中生成的气体是氢气.
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是Fe与Fe3O4
【实验探究】
【实验结论】铁与水蒸气反应的化学方程式为3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为0.03a≤x<0.43a.

(1)【推断】观察到D中黑色固体变红,则B中生成的气体是氢气.
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是Fe与Fe3O4
【实验探究】
| 实验操作 | 实验现象及结论 |
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为0.03a≤x<0.43a.



 水是重要资源.
水是重要资源.