题目内容
5.某化学兴趣小组的同学对蜡烛的燃烧和空气中氧气含量的测定进行了一系列的探究,请你参与并回答下列问题.【发现问题1】点燃蜡烛,发现蜡烛火焰的明亮程度不一样,是什么原因所致呢?
【猜想与假设1】猜想①:蜡烛中可燃物成分不一样;
猜想②:蜡烛烛心棉线长短不同.
【发现问题2】同学们用蜡烛代替红磷测定空气中氧气的含量,发现蜡烛很快熄灭,回流到集气瓶中的水远小于瓶容积的$\frac{1}{5}$.是什么原因所致呢?
【猜想与假设2】猜想①:蜡烛燃烧产生CO2气体;
猜想②:装置漏气;
猜想③:没有冷却至室温.
【实验验证】将蜡烛点燃后用氧气传感器定量测定瓶中的氧气含量.数据如图1.
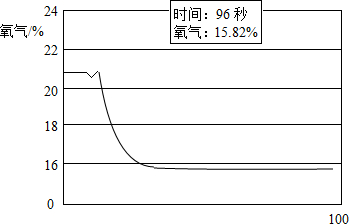
【得出结论】此实验中空气中氧气体积分数降低了5.18%.
【深入探究】
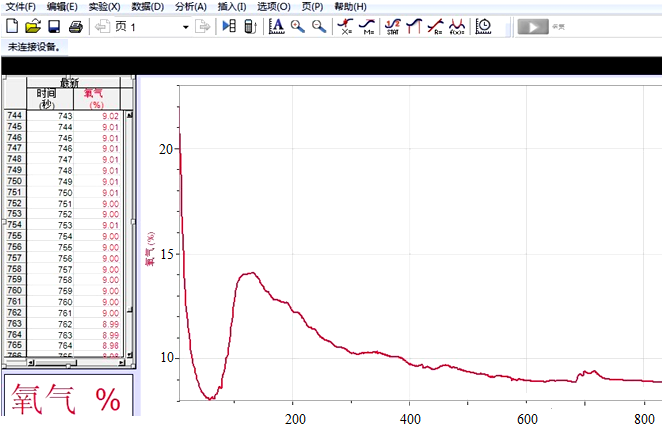
蜡烛燃烧产生的CO2可能是影响蜡烛熄灭的主要原因.请你设计方案除去集气瓶中蜡烛燃烧生成的CO2.在实验前,瓶内加入少量的浓氢氧化钠溶液,燃烧后振荡集气瓶;方案中化学方程式:2NaOH+CO2=Na2CO3+H2O.【拓展研究】某同学用氧气传感器定量测定密闭条件下足量红磷燃烧时氧气的含量变化,如图2,在110秒时氧气的含量有所上升,接着再慢慢下降,最终维持在8.85%左右,请你试着解释图象变化的可能原因是:①红磷燃烧放出热量使得氧气体积膨胀;②装置漏气,空气进入装置.你对氧气含量最终维持在8.85%左右是怎么理解的?当装置的氧气含量低到8.85%时,红磷就不能继续燃烧而熄灭,所以氧气的含量最终维持在8.85%左右.
分析 【猜想与假设1】根据影响燃烧的剧烈程度的因素来分析;
【猜想与假设2】根据发现的问题以及实验装置来分析可能的原因;
【得出结论】根据反应前后氧气含量的数据来分析;
【深入探究】
(1)根据二氧化碳的性质以及反应过程来分析解答;
(2)红磷燃烧放出热量,导致氧气体积膨胀或装置漏气;
氧气含量过低,红磷不能发生燃烧.
磷与氧气在点燃的条件下反应生成五氧化二磷.
解答 解:【猜想与假设1】可能与蜡烛烛心棉线的长短有关,棉线越长,与空气的接触面越大,燃烧也越旺盛,故填:蜡烛烛心棉线长短不同;
【猜想与假设2】蜡烛熄灭后,进入的水的体积远小于瓶子容积的五分之一,可能是蜡烛燃烧生成了二氧化碳,还可能是装置漏气或没有冷却至室温,蜡烛燃烧需要一定的氧气,故填:装置漏气;没有冷却至室温;
【得出结论】反应前,装置内空气中氧气的体积分数约为21%,蜡烛熄灭后,瓶内氧气的含量为15.82%,此实验中空气中氧气体积分数降低了:21%-15.82%=5.18%;故填:5.18;
【深入探究】
(1)二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,故填:在实验前,瓶内加入少量的浓氢氧化钠溶液;2NaOH+CO2=Na2CO3+H2O;
(2)在110秒时氧气的含量有所上升,接着再慢慢下降,可能是红磷燃烧放出热量使得氧气体积膨胀或装置漏气,空气进入装置;故填:红磷燃烧放出热量使得氧气体积膨胀;装置漏气,空气进入装置;
当装置的氧气含量低到8.85%时,红磷就不能继续燃烧而熄灭,所以氧气的含量最终维持在8.85%左右;故填:当装置的氧气含量低到8.85%时,红磷就不能继续燃烧而熄灭;
答案:
【猜想与假设1】蜡烛烛心棉线长短不同;
【猜想与假设2】②装置漏气;③没有冷却至室温;
【得出结论】5.18;
【深入探究】在实验前,瓶内加入少量的浓氢氧化钠溶液,燃烧后振荡集气瓶;2NaOH+CO2=Na2CO3+H2O;
【拓展研究】红磷燃烧放出热量使得氧气体积膨胀;装置漏气,空气进入装置;
当装置的氧气含量低到8.85%时,红磷就不能继续燃烧而熄灭,所以氧气的含量最终维持在8.85%左右;
点评 本题主要考查用蜡烛、红磷测定空气组成的实验原理、操作、现象、结论和注意事项,难度稍大.

 钾是维持人体生命和植物生长所必须的元素.在元素周期表中,钾元素的某些信息如图所示,下列说法不正确的是( )
钾是维持人体生命和植物生长所必须的元素.在元素周期表中,钾元素的某些信息如图所示,下列说法不正确的是( )| A. | 钾元素的符号是K | B. | 钾元素的原子序数为19 | ||
| C. | 钾元素属于非金属元素 | D. | 钾元素的相对原子质量为39.10 |
| A. | 金桂飘香 | B. | 滴水成冰 | C. | 高粱酿酒 | D. | 彩灯闪烁 |
| A. | 用分离液态空气法制取氧气 | B. | 用铁矿石冶炼得到生铁 | ||
| C. | 用稀硫酸除铁锈 | D. | 用葡萄来酿制葡萄酒 |
(1)请你判断:雪状的物质是干冰;
(2)请你设计两个实验分别验证这种物质的成分(按序号填写答案):
| 操作步骤 | 实验现象 | |
| 方法一 | ① | ② |
| 方法二 | ③ | ④ |
③取少量雪状的物质放入澄清石灰水中;④澄清石灰水变浑(或用燃着木条靠近,火焰熄灭等).
