题目内容
13.化学是一门以实验为基础的学科.根据下图回答问题: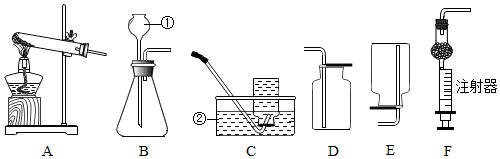
(1)仪器的名称:①长颈漏斗 ②水槽.
(2)实验室用高锰酸钾制取氧气,选用的发生装置是A(填字母序号),其反应的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,但该装置需要做适当的改进,其做法是靠近试管口的地方放一团蓬松的棉花团.
(3)实验室用锌粒和稀硫酸反应制取纯净的氢气,该反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑,常选用发生装置B或F,F与B相比较,其优点是可以控制反应随时发生随时停止.
(4)实验室制取二氧化碳:
①该反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,选用的收集装置是D(填上述字母序号).
②若要证明实验室制取CO2后的废液呈酸性,不可取的实验方法是cd(填下列字母序号):
a.滴加紫色石蕊 b.加入石灰石 c.滴加硝酸银溶液 d.加入铜粉.
分析 (1)熟记仪器的名称;
(2)书写化学式应该注意化学式、配平、条件、箭头;利用高锰酸钾制氧气是固体加热,装置是A;
(3)实验室是用锌粒和稀硫酸在常温下反应制氢气的,根据装置的特点来分析;
(4)根据实验室中制取二氧化碳的原理、收集方法以及酸的性质来分析.
解答 解:(1)①是长颈漏斗;②是水槽;故填:长颈漏斗;水槽;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;故答案为:A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;靠近试管口的地方放一团蓬松的棉花团;
(3)实验室是用锌粒和稀硫酸在常温下反应制氢气的,制取氢气时,用装置F替代装置B的优点是:可以控制反应随时发生随时停止;故答案为:Zn+H2SO4=ZnSO4+H2↑;可以控制反应随时发生随时停止;
(4)①实验室中,通常用大理石或石灰石与稀盐酸反应来制取二氧化碳,二氧化碳的密度比空气大,且能溶于水,所以只能用向上排空气法来收集;故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;D;
②酸性溶液能使紫色的石蕊试液变红色;能与碳酸钙反应生成二氧化碳气体;但是用硝酸银溶液只能证明溶液中含有氯离子,不能证明其显酸性;铜与酸不反应,也无法证明.故填:cd.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列物质的用途中,利用其物理性质的是( )
| A. | 糖类和油脂作为人体供能物质 | B. | 干冰用于人工降雨 | ||
| C. | 一氧化碳用于炼铁 | D. | 食品包装袋中充氮气 |
1.近来,松树蘑菇在娄底市场上卖得很火热,价格也要100元每千克,食用了可以抗癌,就是因为这种蘑菇中含有合成抗癌新药紫衫醇的原料之一:C21H38O11,对于该物质下列就法不正确的是( )
| A. | 属于有机物 | |
| B. | 由碳、氢、氧三种元素组成 | |
| C. | 所含碳元素的质量分数为21% | |
| D. | 1个分子由21个碳原子、38个氢原子和11个氧原子构成 |
5.下列除去杂质(括号内)的方法正确的是( )
| A. | CO2(CO):将气体在空气中点燃 | |
| B. | CO(CO2):将气体通过装有烧碱溶液的洗气瓶 | |
| C. | 铁粉(氧化铁):加入足量的稀盐酸 | |
| D. | Na2SO4溶液(NaOH溶液):加入适量的稀盐酸 |
2. 许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
 许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )| A. | H+ Na+ 0H-NO3- | B. | Na+ K+Cl-OH- | ||
| C. | H+ K+CO32- HCO3- | D. | K+ Ba2+ Cl- SO42- |
3.铁的锈浊对社会生产造成较大损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败.某课外兴趣小组在实验室发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应.测得部分数据加下,请根据有关信息冋答问题.
(1)食品袋内放入“双吸剂”是为了吸收O2、H2O,用铁粉而不用铁块作“双吸剂”的理由是增大与氧气、水分的接触面积,加快反应速率.
(2)a的数值为0.1.
(3)第4次实验,所得到溶液中溶质的化学式为Fe2(SO4)3、FeSO4.
(4)列式计算该样品中单质铁的质量分数(保留至0.1%).
| 实验次数 | 1 | 3 | 4 | 5 | 6 |
| 取样品质量(g) | 31.0 | 31.0 | 31.0 | 31.0 | 31.0 |
| 取稀硫酸质量(g) | 30.0 | 90.0 | 120.0 | 150.0 | 180.0 |
| 产生气体质量(g) | 0 | a | 0.3 | 0.5 | 0.6 |
(2)a的数值为0.1.
(3)第4次实验,所得到溶液中溶质的化学式为Fe2(SO4)3、FeSO4.
(4)列式计算该样品中单质铁的质量分数(保留至0.1%).

