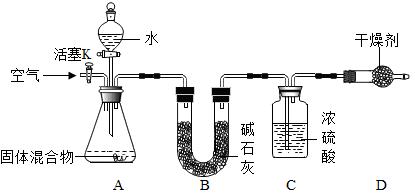
题目内容
6.举例是掌握化学规律的重要方法,下列规律所举实例错误的是( )| 选项 | 化学规律 | 示例 |
| A | 物质结构决定性质 | 由于碳原子排列方式不同,金刚石与石墨物理性质存在很大差异 |
| B | 现象说明微观本质 | 物体热胀冷缩现象,说明构成物质的微粒间距离发生了变化 |
| C | 性质决定物质用途 | 甲醛能使蛋白质变性,可用甲醛溶液浸泡海鲜食品来保鲜 |
| D | 性质决定鉴别方法 | 有些物质燃烧气味不同,可用灼烧闻气味区分羊毛绒和棉线 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据金刚石与石墨物理性质存在很大差异,由于碳原子排列方式不同进行分析;
B、根据物体热胀冷缩现象,说明构成物质的微粒间距离发生了变化进行分析;
C、根据甲醛有毒进性分析;
D、根据羊毛绒和棉线燃烧后的气味不同进行分析.
解答 解:A、金刚石与石墨物理性质存在很大差异,由于碳原子排列方式不同,故A正确;
B、物体热胀冷缩现象,说明构成物质的微粒间距离发生了变化,故B正确;
C、甲醛有毒,所以不能甲醛溶液浸泡海鲜食品来保鲜,故C错误;
D、羊毛绒和棉线燃烧后的气味不同,可以鉴别,故D正确.
故选:C.
点评 本题考查了研究和学习化学的基本方法,明确基本化学知识是解题的关键.

练习册系列答案
相关题目
1.有三瓶失去标签的无色无味气体:氮气、氧气、空气.请你选择一种最简便的方法将他们区分开来.( )
| A. | 带火星的木条 | B. | 铁丝燃烧 | C. | 燃着的木条 | D. | 红磷燃烧 |
11.在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
查阅资料I.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是沉淀消失,形成亮蓝色溶液,而氢氧化铜分解产生的是黑色固体.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许Cu(OH)2可溶于足量水中.
猜想二:Cu(OH)2可在足量NaOH浓溶液中溶解,溶液呈亮蓝色
【实验探究】为验证猜想,同学们用Cu(OH)2粉末(其它试剂可任选)设计如下实验.请你填写表中的空格.
【结论与反思】(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成
Na2Cu(OH)4,反应的化学方程式是2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色.
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
查阅资料I.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是沉淀消失,形成亮蓝色溶液,而氢氧化铜分解产生的是黑色固体.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许Cu(OH)2可溶于足量水中.
猜想二:Cu(OH)2可在足量NaOH浓溶液中溶解,溶液呈亮蓝色
【实验探究】为验证猜想,同学们用Cu(OH)2粉末(其它试剂可任选)设计如下实验.请你填写表中的空格.
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
Na2Cu(OH)4,反应的化学方程式是2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色.
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
15.如图形象的表示某化学反应前后反应物与生成物分子及其数目的变化.则下列叙述正确的是( )
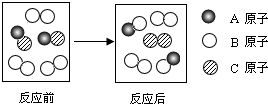

| A. | 该反应前后分子的种类和数目一定改变 | |
| B. | 该反应的生成物都属于氧化物 | |
| C. | 参加反应的A、B、C各原子的个数比为1:2:2 | |
| D. | 该反应的基本类型为置换反应 |
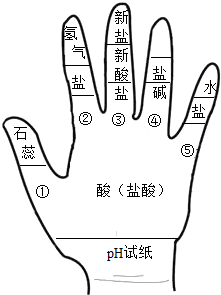 化学与生活、生产息息相关,请用所学化学知识回答.
化学与生活、生产息息相关,请用所学化学知识回答.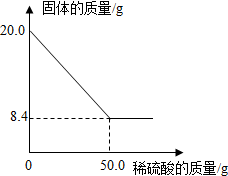 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.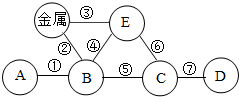 构建知识网络是化学学习中的常用方法.下图是某同学在复习“我们身边的化学物质”时构建的知识网络,其中A、B、C、D、E分别表示非金属氧化物、金属氧化物、酸、碱、盐中的某一种,“-”表示物质之间普遍能够发生的化学反应.
构建知识网络是化学学习中的常用方法.下图是某同学在复习“我们身边的化学物质”时构建的知识网络,其中A、B、C、D、E分别表示非金属氧化物、金属氧化物、酸、碱、盐中的某一种,“-”表示物质之间普遍能够发生的化学反应.