题目内容
5.联氨(N2H4)是发射火箭时常用的燃料,用四氧化二氮(N2O4)做助燃剂,它们反应生成的物质不会对大气造成污染.(1)反应的化学方程式为2N2H4+N2O4═3N2+4H2O
(2)请计算4.8kg N2H4完全燃烧需要多少kg助燃剂N2O4?(列式计算)
分析 (1)根据质量守恒定律解答;
(2)根据化学方程式,已知N2H4的质量进行计算解出助燃剂N2O4的质量.
解答 解:
(1)根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减.从化学方程式2N2H4+N2O4═3X+4H2O看,反应前反应物中N、H、O元素的原子个数依次为:6、8、4;反应后生成物中除3X外,H、O元素的原子个数为8、4.比较反应前后原子种类及个数可得知,3X中应含有6个N原子,所以X的化学式为N2.
(2)设需要助燃剂N2O4的质量为x,
2N2H4+N2O4═3N2+4H2O
64 92
4.8kg x
$\frac{64}{92}$=$\frac{4.8kg}{x}$
x=6.9kg
答案:
(1)N2
(2)4.8kg N2H4完全燃烧需要6.9kg助燃剂N2O4
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
16.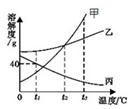 如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
 如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )| A. | 甲溶液 | B. | 乙溶液 | C. | 丙溶液 | D. | 甲乙丙均可 |
13.下面是某同学的笔记,他少记了一处.下列对该笔记“三”处的补充正确的是( )

| A. | CO2 Fe2O3 | B. | Na2CO3 NaCl | C. | KOH Ba(OH)2 | D. | HNO3 H2CO3 |
20.石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品50g,平均分成4份.进行实验,结果如下:
(1)哪几次反应中矿石有剩余?
(2)上表中m的数值是多少?
(3)试计算这种石灰石矿中碳酸钙的质量分数.
| 实验 | 1 | 2 | 3 | 4 |
| 加入盐酸的质量/g | 50 | 100 | 150 | 200 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(2)上表中m的数值是多少?
(3)试计算这种石灰石矿中碳酸钙的质量分数.
10.有一包白色固体,可能含有Na2CO3一种白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,沉淀完全溶解并有气体产生.由此推断白色固体中( )
| A. | 可能存在NaOH | B. | 可能存在Na2SO4 | ||
| C. | 肯定不存在BaCl2 | D. | 肯定存在Na2CO3和Na2SO4 |
14.下列有关实验现象的描述错误的是( )
| A. | 将碳酸钠固体放入稀硫酸中有大量气泡产生 | |
| B. | 将稀盐酸滴入氢氧化钠溶液中观察不到明显变化 | |
| C. | 在电解水实验中,正极产生的气体比负极产生的气体体积小 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射,生成黑色四氧化三铁固体 |
15.为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( )
| 选项 | 物质 | 操作方法 |
| A | CaO粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| B | Fe(Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
| C | NaOH溶液[Ca(OH)2溶液] | 通入过量CO2气体,充分反应后过滤 |
| D | CuSO4溶液(硫酸) | 加入过量CuO粉末,加热,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |



