��Ŀ����
|
�о���ѧϰ��̽��ʵ�����о��õ�NaOH�ı��ʳ̶� | ||||||
| ||||||
| (2)��ʵ���������NaOH��Ӧ��������������� (3)���ݡ���NaOH��Ӧ���������������������ͼ���㷢����ʲô���⣿ | ||||||
 |
(1) |
|
(2)û����������������Ϊ13.3g��5.3g=8g ��μӷ�Ӧ�Ȼ��������Ϊm NaOH+HCl=NaCl+H2O 40 36.58g 8g m 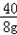 = =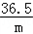 m=8g�� m=8g��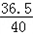 =7.3g�� =7.3g�����������= 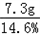 ��100%=50g�� ��100%=50g��(3)NaOH���кͺμ����ᣬΪʲôû����������CO2���壮 |

��1����ͬѧ���α��Ļ���֪ʶ����������ͼ��������������������ݣ�

| ��ȡ���� | ����ҪƷ | װ������˳�� | ��Ӧ�Ļ�ѧ����ʽ |
| ���� | ����غͶ������� | ||
| ������̼����� | ����ʯ��ϡ���� |
K2ʱ������I����װ�ÿ�ֱ�ӽ��е�ʵ����

�ٴ���ʯ��ϡ���ᷴӦ��ȡ������̼
��п��ϡ���ᷴӦ��ȡ����
��3����ͬѧ��Ϊ�ڲ��ı�I����װ�õ�������
λ�õ�ǰ���£���װ�ÿ����ڹ������ƣ�Na2O2����ˮ��Ӧ��ȡ��������һ����Ϊ�������ƣ���÷�Ӧ�Ļ�ѧ����ʽΪ��
��4����ͬѧ��K2���ر�K1������I����װ������֤���ɵĶ�����̼�к���ˮ��������ʱC��ʢ�ŵ�������
��5����������غͶ������̵Ļ������ȡO2��Ĺ���������ٶ�����ȫ��Ӧ�������»��մ�����
��ͨ�������IJ�ʵ��������ն������̣���ȷ�������Ⱥ�˳����
a�����b���ܽ�c������d��ϴ��
���������Ȼ��ؾ�������50g��������Ϊ5%���Ȼ�����Һ����Ҫ�Ȼ��ص�����Ϊ
�۹��ˡ�����ʱ�����õ���������
A���ƾ���B���ձ�C��������D��©��E����Ͳ
��6��С����6.5g���ܺ���ͭ����������þ�е�һ�ֻ��ֽ������ʵ�п�ۣ���������ϡ������ȫ��Ӧʱ������0.2g���������п����һ�����еĽ���������
ij�о���ѧϰС���ͬѧ����������װ��̽����ɫֲ������������Ƿ���
CO2�����������Ƶ�̽���������£���ش����е��й����⣮

��1�����裺��ɫֲ���ں�����������CO2���������
��2����Ʒ�����ʹ��ɫֲ���ڱܹ�ĺڰ��������������ã�������������в��������壮
��3���������ϣ�����ɫֲ�������ù��̣�ˮ+������̼һ���л���+����
����ɫֲ��������ù��̣��л���+����һ��������̼+ˮ+����
��4��ʵ�飺
| �������� | ��� |
| �� ����װ�ð���ͼ ��ʾ���Ӻò�װ�뻯ѧ�Լ��� C�з�����ɫֲ�� | �� Aװ�õ������� �� Bװ�õ������� �� C�������ֲ������ԭ����________________
|
| �� ��A�ĵ��ܿڻ������� �������һ��ʱ�� | �� Aװ����Ӧ�۲쵽��������ʯ��ˮ����� ��Dװ����Ӧ�۲쵽��������ʯ��ˮ����� |
��5�����������ۣ����ж����̽��ʵ��________����ɹ������ɹ�������
��������о���ѧϰС��̽��ʵ�鲻�ɹ���ԭ���Ƕ��ġ������ʵ�������������ҳ����ܵ�һ��ԭ��________________________________��
ij�о���ѧϰС���ͬѧ����������װ��̽����ɫֲ������������Ƿ���
CO2�����������Ƶ�̽���������£���ش����е��й����⣮

��1�����裺��ɫֲ���ں�����������CO2���������
��2����Ʒ�����ʹ��ɫֲ���ڱܹ�ĺڰ��������������ã�������������в��������壮
��3���������ϣ�����ɫֲ�������ù��̣�ˮ+������̼һ���л���+����
����ɫֲ��������ù��̣��л���+����һ��������̼+ˮ+����
��4��ʵ�飺
| �������� | ��� |
| �� ����װ�ð���ͼ ��ʾ���Ӻò�װ�뻯ѧ�Լ���C�з�����ɫֲ�� | �� Aװ�õ������� �� Bװ�õ������� �� C�������ֲ������ԭ����________________
|
| �� ��A�ĵ��ܿڻ������� �������һ��ʱ�� | �� Aװ����Ӧ�۲쵽��������ʯ��ˮ����� �� Dװ����Ӧ�۲쵽��������ʯ��ˮ����� |
��5�����������ۣ����ж����̽��ʵ��________����ɹ������ɹ�������
��������о���ѧϰС��̽��ʵ�鲻�ɹ���ԭ���Ƕ��ġ������ʵ�������������ҳ����ܵ�һ��ԭ��________________________________��
 34��ij�о���ѧϰС��̽��CuSO4��Һ��NaOH��Һ�ķ�Ӧ���
34��ij�о���ѧϰС��̽��CuSO4��Һ��NaOH��Һ�ķ�Ӧ���