题目内容
4.过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶质的质量分数会变小.某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行实验.测得相关数据如图所示:
(1)剩余的混合物中二氧化锰的质量为2g
(2)反应生成氧气的质量为1.6g
(3)计算该过氧化氢溶液中溶质的质量分数.(写出计算过程)
分析 (1)根据二氧化锰是催化剂反应前后质量和化学性质不变来分析;
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量;
(2)根据过氧化氢分解的化学方程式和(2)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,然后根据质量分数公式计算即可.
解答 解:(1)二氧化锰是催化剂反应前后质量和化学性质不变;故剩余的混合物中二氧化锰的质量2g;故填:2;
(2)根据质量守恒定律,反应生成氧气的质量为:68g+2.0g-68.4g═1.6g;故填:1.6;
(3)计算该过氧化氢溶液中溶质的质量分数.
解:设过氧化氢溶液中溶质的质量为x,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 1.6g
$\frac{68}{x}=\frac{32}{1.6g}$
X═3.4g
该过氧化氢溶液中溶质的质量分数为:
$\frac{3.4g}{68g}$×100%═5%
答:该过氧化氢溶液中溶质的质量分数为5%.
点评 本题主要考查学生根据质量守恒定律,运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目
14.下列化学实验基本操作正确的是( )
| A. |  过滤 | B. |  称取氯化钠 | C. |  稀释浓硫酸 | D. |  测溶液的pH |
19.科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图1所示).某化学小组的同学对此非常感兴趣,在老师的指导下,设计如图2装置探究上述设想的反应原理是否可行.

(1)能证明装置A“释放CO2”的现象是C中的石灰水变浑浊;
(2)上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2.
【猜想与假设】
D中的固体可能为:Ⅰ.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙
【进行实验】
①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立.乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是氧化钙与水反应生成的氢氧化钙微溶,也可能出现不溶物.
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是由于滴加盐酸的量太少,盐酸先于氢氧化钙反应,即使有碳酸钙,也不会出现气泡.
③丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和
稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告.
(3)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的.该设想的优点有ABC(填字母序号).
A.原料易得 B.充分利用太阳能 C.释放出的CO2可作为资源加以利用.

(1)能证明装置A“释放CO2”的现象是C中的石灰水变浑浊;
(2)上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2.
【猜想与假设】
D中的固体可能为:Ⅰ.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙
【进行实验】
①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立.乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是氧化钙与水反应生成的氢氧化钙微溶,也可能出现不溶物.
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是由于滴加盐酸的量太少,盐酸先于氢氧化钙反应,即使有碳酸钙,也不会出现气泡.
③丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和
稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量D中固体,加水充分溶解,过滤 ①取滤液,滴加几滴无色酚酞试液 ②向滤出的固体中滴加足量的稀盐酸 | ①溶液变为红色 ②固体表面有气泡冒出 | 猜想Ⅱ成立 |
A.原料易得 B.充分利用太阳能 C.释放出的CO2可作为资源加以利用.
9.以下是我校某同学在化学小测中书写的化学方程式,其中不正确的是( )
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | ||
| C. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
16.以下应用守恒思想解决相关问题,推论正确的是( )
| A. | 2g氢气与18g氧气反应,根据质量守恒推出生成的水的质量为20g | |
| B. | 丙烷燃烧生成二氧化碳和水,根据元素守恒推出丙烷由碳、氢、氧元素组成 | |
| C. | 100mL36%的浓盐酸用300 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为9% | |
| D. | 相同分子数的CO和O2混合,在一定条件下充分反应,根据原子守恒推出反应后气体中C、O原子数比为1:3 |
 水与人类的生活和生产密切相关,请回答下列问题:
水与人类的生活和生产密切相关,请回答下列问题: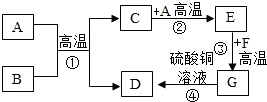 A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题:
A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题: