4.(2009四川卷文)某企业生产甲、乙两种产品,已知生产每吨甲产品要用A原料3吨,B原料2吨;生产每吨乙产品要用A原料1吨,B原料3吨,销售每吨甲产品可获得利润5万元,每吨乙产品可获得利润3万元。该企业在一个生产周期内消耗A原料不超过13吨,B原料不超过18吨.那么该企业可获得最大利润是
A. 12万元 B. 20万元 C. 25万元 D. 27万元
答案 D
 解析 设生产甲产品
解析 设生产甲产品 吨,生产乙产品
吨,生产乙产品 吨,则有关系:
吨,则有关系:
|
|
A原料 |
B原料 |
甲产品 吨 吨 |
3 |
2 |
乙产品 吨 吨 |
 |
3 |
则有:
目标函数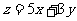
作出可行域后求出可行域边界上各端点的坐标,经验证知:
当 =3,
=3, =5时可获得最大利润为27万元,故选D
=5时可获得最大利润为27万元,故选D
4.离子反应的应用
(1)物质检验与含量测定:只要对其中特定的离子进行检验或测定即可,不必对物质的所有构成离子进行检验和测定。定量测定的方法包括酸碱中和滴定法、氧化还原滴定法、沉淀滴定法、络合滴定法等。
附:常见离子的检验
|
离子 |
所用试剂或操作 |
现象 |
相关方程式 |
|
NH4+ |
加浓碱液、△ |
产生刺激性气味气体,且使湿润红色石蕊试纸变蓝 |
NH4+ + OH– NH3↑+ H2O
NH3↑+ H2O |
|
Mg2+ |
加过量NaOH溶液 |
产生白色沉淀 |
Mg2+ + 2OH– = Mg(OH)2↓ |
|
Al3+ |
加过量氨水,后加NaOH |
产生白色沉淀,加NaOH时沉淀溶解 |
Al3++3NH3•H2O = Al(OH)3↓+3NH4+ Al(OH)3+ OH–= [Al(OH)4]-+ 2H2O |
|
Fe2+ |
加NaOH溶液 |
产生白色沉淀,后迅速变灰绿,最终变红褐色沉淀 |
Fe2+ + 2OH– = Fe (OH)2↓ 4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3 |
|
Fe3+ |
加KSCN溶液 |
溶液变血红色 |
Fe3+ + SCN– = [Fe(SCN)]2+ |
|
Ag+ |
加NaCl溶液,后加稀HNO3 |
产物白色↓,加稀HNO3后不溶 |
Ag+ + Cl– = AgCl↓ |
|
Cl– |
加稀HNO3酸化的AgNO3溶液 |
产生白色沉淀 |
Ag+ + Cl– = AgCl↓ |
|
Br– |
加稀HNO3酸化的AgNO3溶液 |
产生淡黄色沉淀 |
Ag+ + Br– = AgBr↓ |
|
I– |
加稀HNO3酸化的AgNO3溶液 |
产生黄色沉淀 |
Ag+ + I– =AgI↓ |
|
SO42– |
加HCl酸化的BaCl2 |
产生白色沉淀 |
Ba2++SO42–= BaSO4↓ |
|
SO32– |
加盐酸后,产生气体,通入品红试液,加热 |
产生无色刺激性气味气体,且使品红试液褪色,加热后恢复原色 |
2H++ SO32–=SO2↑+H2O |
|
NO3– |
加Cu和浓H2SO4,加热浓缩 |
产生红棕色气体,溶液变蓝 |
Cu+2H2SO4(浓)+2NaNO3 CuSO4+Na2SO4+2NO2↑+2H2O CuSO4+Na2SO4+2NO2↑+2H2O |
|
PO43– |
加AgNO3溶液,后加稀HNO3 |
产生黄沉淀,加酸后沉淀溶解 |
3Ag++ PO43–=
Ag3PO4↓Ag3PO4+3H+=3Ag++H3PO4 |
|
CO32– |
加盐酸后,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2H++CO32–=CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
|
HCO3– |
加热,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2NaHCO3 Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
(2)物质的制备与纯化
(3)生活中的应用
 B.
B. C.
C. D.
D.
 可得
可得 ,故
,故 阴 =
阴 = ,选C。
,选C。 所表示的平面区域被直线
所表示的平面区域被直线 分为面积相等的两部分,则
分为面积相等的两部分,则 的值是
的值是  B.
B.  C.
C. D.
D. 
 解析 不等式表示的平面区域如图所示阴影部分△ABC
解析 不等式表示的平面区域如图所示阴影部分△ABC 得A(1,1),又B(0,4),C(0,
得A(1,1),又B(0,4),C(0, △ABC=
△ABC= ,设
,设 与
与 的
的 知
知 ,∴
,∴
 ∴
∴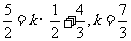 选A。
选A。  (2009山东卷理)设x,y满足约束条件
(2009山东卷理)设x,y满足约束条件 ,
, 的最小值为 ( ).
的最小值为 ( ).  B.
B. C.
C.  D.
4
D.
4 ,故选A.
,故选A. [Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。
[Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。