网址:http://m.1010jiajiao.com/timu_id_97096[举报]
第I卷(共66分)
一、选择:(2×5=10分) 三、选择:(4×5=20分)
题号
1
2
3
4
5
题号
18
19
20
21
22
答案
A
C
D
D
D
答案
BC
B
AC
BD
C
二、选择:(3×12=36分)
题号
6
7
8
9
10
11
答案
D
C
C
B
C
D
题号
12
13
14
15
16
17
答案
D
D
A
B
C
C
第II卷(共84分)
四、(24分)
23.(8分):(1) H2SO4+V2O5→(VO2)2SO4+H2O,不是。(2分)
(2)2VO2+
+ H
2VO2+ (1分),V+5 (1分)。 VO2+在酸性条件下和Cl2氧化性的相对大小。(2分)
24.(8分) (1)BD(2分)
(2)C (1分) 该反应达到平衡时,平衡常数K=-----化学.files/image038.gif) ,增大容器体积时,
,增大容器体积时,
c(CH3OH)
c(CO)等比例减小,由于H2浓度不变,此时-----化学.files/image040.gif) 的值仍然等于K,所以平衡
的值仍然等于K,所以平衡
不移动。(2)
(3)越高(1分)
原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高碳转化率又降低且有甲烷生成。(2分)
25.(8分)
(1)第三周期第VIIA族 5 (各1分,共2分) (2)H2O NH3 (2分)
(3)离子键 共价键(配位键不要求)(2分)(4)4NO + 3O2 + 2H2O → 4HNO3(2分)
五、(24分)
26(12分)(1) 防倒吸(1分) ①(2分)
(2)Cl2+SO2+2H2O→4H++2Cl?+SO42?(2分)
(3)②(1分)③(或④)(2分)溶液呈红色((或紫红色)(2分)⑥(1分)红色褪成无色(1分)
27.(12分)
(1)ABE(2分,对2个给1分,有错不给分)
(2)FeSO4?7H2O(1分),( NH4)2 SO4(1分);c(NH4+)>c(SO42-)> c(H+)>c(OH-) (2分)
(3)硫酸作用抑制Fe2+的水解,铁皮的作用防止Fe3+的氧化。(2分,各1分)
(4)在试管中取滤液少许,加入足量的NaOH溶液,加热,用湿润的红色石蕊试纸检验,若试纸变兰色,则证明滤液中含有NH4+。(2分)
(5)FeSO4+2NH4HCO3 →FeCO3↓+( NH4)2 SO4+ CO2↑+H2O(2分)
-----化学.files/image041.gif) 六、(20分)
六、(20分)
28.(8分)(1)①CH3-CH=CH-C≡C-CH=CH-C≡C-CH3 (2分) ② (其它合理也给分(2分)
-----化学.files/image042.gif) (2)
(2)
①2RHC=CHR’ RHC=CHR + R’HC=CHR’ (1分)
-----化学.files/image043.gif)
-----化学.files/image044.gif) ②RHC=CHR’
RHC=CHR + R’HC=CHR’ (1分)
②RHC=CHR’
RHC=CHR + R’HC=CHR’ (1分)
RHC=CHR’
③用同位素示踪法;利用含重氢的烯烃RCD=CHR’进行反应。若产物有RCD=CDR和R’CH=CHR’,证明反应按机理b进行;若产物有RCD=CHR和R’CD=CHR’, 证明反应按机理a进行。(1分)
29.(12分)(1) 2-丙醇 (1分)
-----化学.files/image046.jpg)
(2) (2分) 3 (2分)
-----化学.files/image048.jpg)
(3)(2分)CH3COCH3+2-----化学.files/image050.jpg) → H2O+
→ H2O+
取代反应(1分)
-----化学.files/image052.jpg) (4)6mol (2分)
(4)6mol (2分)
(5) 另一种是酚羟基与羧基之间缩聚:结构简式略。(各1分)
七、(16分)
30.(6分)(1)n(Fe)=
n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol (2分)
盐基度=n(OH-)/3n(Fe)×100%= 0.015 mol/(3×0.035 mol) ×100%=14.29% (2分)
(2)n(H2O)=(
31. (10分) (1)504 (1分)
(2)由题意可知,天然碱含
-----化学.files/image054.gif)
-----化学.files/image056.gif)
(2分)
(3)2.5 (2分) (4)0<W<4.98 V(CO2)=202.4W(mL)(2分)
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)(2分) W>12.45
V(CO2)=0 (1分)
注:30mL中所含HCl物质的量:
-----化学.files/image058.gif)
和30mL 完全反应的样品的质量:-----化学.files/image060.gif)
样品中和盐酸反应完全生成(没有放出时),样品的质量: -----化学.files/image062.gif)
两分子烯烃A在苯中用一特殊催化剂处理时生成两种新的烯烃B和C:2A
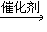 B+C
B+C 请回答下列问题。
(1)若A为RHC=CHR’,B为RHC=CHR,试写出上述化学反应方程式________。
(2)对上述反应提出两种反应机理(竖线表示断键位置):机理a是RHC=CH+R'
R+HC=CHR'
 B+C 则机理b是________________B+C
B+C 则机理b是________________B+C (3)根据课本学过的知识回答:采用何种方法能证明反应机理是a或是b?_______________。
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(1)写出上述反应的离子方程式
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有 关的各项反应条件.其中:
①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是
③B和C的组合比较所研究的问题是
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:
Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 ,该反应不需使用指示剂的原因是 ;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验
序号 反应温度
(℃) 参加反应的物质
Na2S2O3 H2SO4 H2O
V/mL c/mol•L-1 V/mL c/mol•L-1 V/mL
A 20 10 0.1 10 0.1 0
B 20 5 0.1 10 0.1 5
C 20 10 0.1 5 0.1 5
D 40 5 0.1 10 0.1 5
(1)写出上述反应的离子方程式
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有 关的各项反应条件.其中:
①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是
③B和C的组合比较所研究的问题是
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:
查看习题详情和答案>>
Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 ,该反应不需使用指示剂的原因是 ;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(1)写出上述反应的离子方程式
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有 关的各项反应条件.其中:
①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是
③B和C的组合比较所研究的问题是
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因: 查看习题详情和答案>>