网址:http://m.1010jiajiao.com/timu_id_92593[举报]
一、选择题(本大题共10题,每小题2分,共20分)每小题给出的四个选项中,只有一个最符合题意,请将其序号涂在答题卡上。
题号
1
2
3
4
5
6
7
8
9
10
答案
B
B
C
D
C
C
B
D
A
D
二、选择题(本大题共5题,每小题2分,共10分)每小题给出的四个选项中,有1~2个符合题意。只有一个选项符合题意的多选不给分;有2个选项符合题意的只选一个且符合题意给1分,若选2个有一个不符合题意则不给分。
题号
11
12
13
14
15
答案
B
B
B
BD
C
三、(本大题共5题 共29分)
16.(6分)(每空1分) (1)16 6 (2)2H Na+ (3)22 1:8
17.(7分)(每空1分) (1)天然气 (2)盖上锅盖 使可燃物与空气隔绝 (3)分别取少量样品至于试管中,加入少量食醋,若产生气泡的则是纯碱,无现象的是食盐。 (4)元素
(5)聚氯乙烯 (6)吸附
18.(5分)(每空1分) (1)①(2)①碳酸钙 水 ② ③能量
③能量
19.(9分)(每空1分,化学方程式2分) (1)分子之间有间隙(2)氧气 8:1
水是由氢、氧两种元素组成的。(其他合理答案也可给分) (3)蒸馏水
(4)煮沸水(5)过滤雨水中的固体杂质(6)
20.(2分) 89.9%
四、(本大题共4题 共31分)
21.(8分)每个化学方程式2分。
(1)Ca(OH)2 + CO2 ====CaCO3↓+ H2O
(4)2H2O2=====2H2O+O2↑
22.(9分)(每空1分) (1)①长颈漏斗 ②集气瓶 (2)AD或AE 固体与固体反应且需要加热;氧气的密度比空气略大,氧气不易溶于水(3)BE 将燃着的木条放在集气瓶口,若木条立即熄灭,证明二氧化碳已集满 A D (4)防止CO2溶于水(或防止CO2与水反应、防止CO2与水接触),没有
 23.(4分)(每空1分,化学方程式2分) (1)CuO (2)C+2CuO=====2Cu+CO2↑(3)不同
23.(4分)(每空1分,化学方程式2分) (1)CuO (2)C+2CuO=====2Cu+CO2↑(3)不同
24.(10分) (每空1分)
(1)过滤 蒸发 (2)①a>b=c ②MgSO4 (3)①氢氧化钠或氢氧化钙 盐酸 ②Na2SO4 除去CaCl2和过量的BaCl2(4)取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水;CH4?8H2O
五、(本大题共2题 共10分)
25.(6分)解:设反应的锌的质量为x,生成的硫酸锌的质量为y。
Zn+H2SO4====ZnSO4+H2↑
65 161 2
x
y
65:x =2:
x =
y =
样品中铜的质量为
硫酸锌溶液的质量为
硫酸锌溶液的溶质质量分数为
答:略。
26.(4分)
(1)碳酸钙 ………1分
(2)产生的二氧化碳质量=
设盐酸中氯化氢的质量为x。
CaCO3+2HCl====CaCl2+H2O+CO2↑
73 44
x

x=
盐酸的溶质的质量分数=
答:略。
 |
本资料由《七彩教育网》www.7caiedu.cn 提供!
①做细铁丝在氧气中燃烧的实验时,氧气的集气瓶底炸裂.
答:
②用试管加热水时 发现试管炸裂
答:
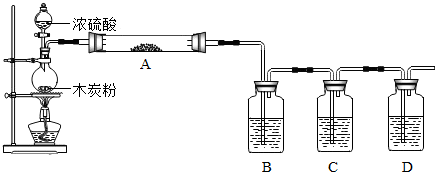
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
| ||
| ||
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是
B中加入的试剂是
C中加入的试剂是
D中加入的试剂是

(1)写出标号仪器的名称:a
(2)检查上图B装置气密性的方法是
(3)实验室用加热高锰酸钾制取氧气的化学方程式为
| ||
| ||
(4)实验室用5%的过氧化氢溶液和二氧化锰混合制取氧气,它的化学方程式为
| ||
| ||
(5)因为氧气的密度比空气
(1)北京奥运村的生活热水都是由太阳能热水利用系统提供.下列关于太阳能的说法中,正确的是
A.是化石燃料;B.取之不尽;C.可转化为热能、电能;D.是无污染能源
(2)为了确保“水立方”的水质达到国际泳联最新卫生标准,泳池的水将采用“砂滤-臭氧-活性炭”净水工艺,其中活性炭净水是利用它的

(3)北京奥运祥云火炬上端的外壁有430个通气孔(如右图所示)
这些孔不仅能把燃烧的废气排出去,还能
(4)在举重项目中,我国体育健儿取得娇人的成绩.举重运动员在抓杠铃前常擦一种白色粉末碳酸镁,碳酸镁的化学式是
(1)如果硫粉在氧气中燃烧,观察到的现象是
| ||
| ||
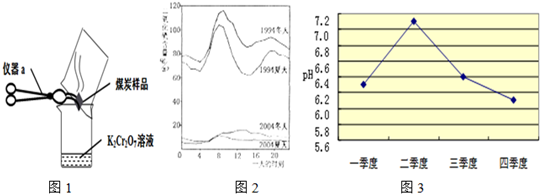
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称:
 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).

