网址:http://m.1010jiajiao.com/timu_id_920847[举报]
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
(1)实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、量筒, 还需要的仪器有 ;
【方案一】在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明 。
[反思]:有的同学认为这种方案不够合理,理由是_________________________________。
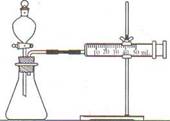
【方案二】(1)连接仪器组装成如右图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气? 。
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式: ;
要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定 。
[拓展] 镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量的氢气,则镁与铝的质量比为 。(2分)
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:
查看习题详情和答案>>
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
(1)实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、量筒, 还需要的仪器有 ;
【方案一】在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明 。
[反思]:有的同学认为这种方案不够合理,理由是_________________________________。
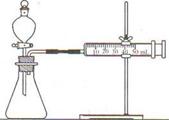
【方案二】(1)连接仪器组装成如右图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气? 。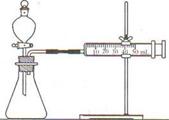
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式: ;
要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定 。
[拓展] 镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量的氢气,则镁与铝的质量比为 。(2分)
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:
现用98%的浓硫酸配制1000 mL溶质质量分数为20%的稀硫酸(密度为1.14 g/mL)。下列说法正确的是( )
A.配制时应将水小心地加入浓硫酸中
B.该稀硫酸中,溶剂质量:溶质质量=5:1
C.实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管等
D.配制该稀硫酸需要加水800 mL
查看习题详情和答案>>
现用98%的浓硫酸配制1000 mL溶质质量分数为20%的稀硫酸(密度为1.14 g/mL)。下列说法正确的是( )
A.配制时应将水小心地加入浓硫酸中
B.该稀硫酸中,溶剂质量:溶质质量=5:1
C.实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管等
D.配制该稀硫酸需要加水800 mL
查看习题详情和答案>>
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、胶头滴管, 还 需要的仪器有 ;在稀释时,一定要 ,并不断搅拌。
(2)准备两块表面积相同的镁条和铝条,并除去表面的氧化膜。要求两种金属片表面积相同的原因是 。
【方案一】将除去氧化膜的镁条、铝条,分别与相同体积相同质量分数的硫酸反应,观察到 镁比铝反应更剧烈,说明 。
【方案二】(1)连接仪器组装成如右图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出 的针筒活塞一段时间后又回到原来的位置,你 认为该装置是否漏气? 。
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反 应的化学方程式: ; 要比较两种金属活动性强弱,可以测定两种金属与
硫酸反应得到相同体积氢气所需要的时间;还可测定 。
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱: 。