摘要:(2)制得的氢气含有少量的水蒸气和HCl气体.若要得到干燥.纯净的氢气.需要通过③和④装置.则装置按导管字母连接的顺序是:发生装置 → → → → →收集装置.(3)若要检验氢气中的杂质HCl.可把④装置中的试剂换成 溶液.实验中观察到有白色沉淀生成.写出相应的化学方程式 . (4)图中的⑤ 装置是一个用排空气法收集氢气的装置.请你判断气体应由 进 出 .
网址:http://m.1010jiajiao.com/timu_id_917777[举报]
以下是小阳同学制取氢气的实验过程,根据题意回答以下问题。
(1) 如果他用锌粒和稀盐酸来制取氢气,可以选择 (填序号)做发生装置;装置②的主要仪器有分液漏斗、带导管的双孔胶塞和 (填仪器名称)。
(1) 如果他用锌粒和稀盐酸来制取氢气,可以选择 (填序号)做发生装置;装置②的主要仪器有分液漏斗、带导管的双孔胶塞和 (填仪器名称)。
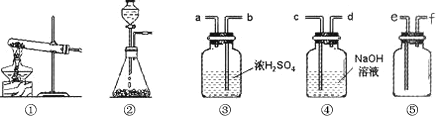
(2) 制得的氢气含有少量水蒸气和HCI气体,若要得到干燥、纯净的氢气,需要通过③和④装置,则装置按导管字母连接的顺序是:发生装置→ → → → → 收集装置(填字母)。
(3) 若要检验氢气中的杂质HCl,可把④装置中的试剂换成 (填化学式)溶液,实验中观察到有白色沉淀生成,写出相应的化学方程式 。
(4) 图中的⑤装置是一个用排空气法收集氢气的装置,请你判断气体应由 进_______出(填字母)。
查看习题详情和答案>>
(3) 若要检验氢气中的杂质HCl,可把④装置中的试剂换成 (填化学式)溶液,实验中观察到有白色沉淀生成,写出相应的化学方程式 。
(4) 图中的⑤装置是一个用排空气法收集氢气的装置,请你判断气体应由 进_______出(填字母)。
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2表示.
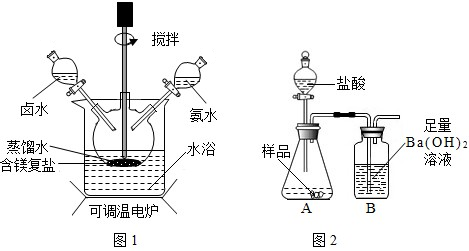
【探究一】
碱式碳酸镁的制备碱式碳酸镁可用MgCO3和(NH4)2CO3
作原料制备.取一定量的原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),加入一定量蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120℃干燥得到碱式碳酸镁产品.回答下列问题:
(1)①搅拌的目的是
(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有
(3)图1设计实验检验碱式碳酸镁中含有Cl-
【探究二】定量测定碱式碳酸镁的组成
现利用图2所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碱式碳酸镁中MgCO3的质量分数.请回答下列问题.
(1)若测定值比实际值小,可能的原因有
①装置A中水蒸气、HCl等进入装置B中
②装置A中CO2未完全进入装置B
③CO2气流速度太快导致Ba(OH)2未完全吸收
④盐酸未滴加过量
(2)为减少误差,现采取一些措施:为防止HCl进入B装置,可在A、B之间增加装有
(3)准确称取8.00g样品三份,进行测定,测得BaCO3平均质量为3.94g.试计算样品中MgCO3的质量分数(写出计算过程).
查看习题详情和答案>>

【探究一】
碱式碳酸镁的制备碱式碳酸镁可用MgCO3和(NH4)2CO3
作原料制备.取一定量的原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),加入一定量蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120℃干燥得到碱式碳酸镁产品.回答下列问题:
(1)①搅拌的目的是
加快原料的溶解速度
加快原料的溶解速度
;②选择水浴加热方式,其优点是受热均匀
受热均匀
.(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有
NH4Cl
NH4Cl
(填化学式).(3)图1设计实验检验碱式碳酸镁中含有Cl-
| 实 验 操 作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银 硝酸银 溶液 |
现象① 有气泡产生 有气泡产生 ;现象② 有白色沉淀生成 有白色沉淀生成 ; |
含有Cl- |
现利用图2所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碱式碳酸镁中MgCO3的质量分数.请回答下列问题.
(1)若测定值比实际值小,可能的原因有
②③④
②③④
.(填序号)①装置A中水蒸气、HCl等进入装置B中
②装置A中CO2未完全进入装置B
③CO2气流速度太快导致Ba(OH)2未完全吸收
④盐酸未滴加过量
(2)为减少误差,现采取一些措施:为防止HCl进入B装置,可在A、B之间增加装有
氢氧化钠
氢氧化钠
(填药品名称或化学式)溶液的洗气瓶;将装置B中的长导管下方增加一个带孔球泡,可以提高反应速度
反应速度
;在装置B的后面再增加一个装有碱石灰
碱石灰
(填药品名称或化学式)的干燥管.(3)准确称取8.00g样品三份,进行测定,测得BaCO3平均质量为3.94g.试计算样品中MgCO3的质量分数(写出计算过程).
 实验室常用石灰石和稀盐酸制取二氧化碳气体,在收集到的气体里含有少量的氯化氢气体和水蒸气,要得到干燥纯净的二氧化碳气体,可用下列装置来制取二氧化碳,请回答下列问题:
实验室常用石灰石和稀盐酸制取二氧化碳气体,在收集到的气体里含有少量的氯化氢气体和水蒸气,要得到干燥纯净的二氧化碳气体,可用下列装置来制取二氧化碳,请回答下列问题:(1)指出标号仪器名称:b
锥形瓶
锥形瓶
.(2)装置A中发生的化学反应方程式
CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
.(3)装置B用于
吸收HCl气体或除去HCl气体
吸收HCl气体或除去HCl气体
,发生化学反应的化学方程式是2HCl+Na2CO3═2NaCl+CO2↑+H2O
2HCl+Na2CO3═2NaCl+CO2↑+H2O
.(4)装置C的作用是
干燥CO2气体或吸收水蒸汽.
干燥CO2气体或吸收水蒸汽.
.(5)装置D中如何得知已收集满CO2气体,用
燃烧的木条放在集气瓶口熄灭
燃烧的木条放在集气瓶口熄灭
.
课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定.
粗产品制备:
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为 .
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
粗产品成分分析:
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ,该粗产品中一定不含有 ,理由是 .
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质.
粗产品含量测定:
Na2CO3含量的测定:
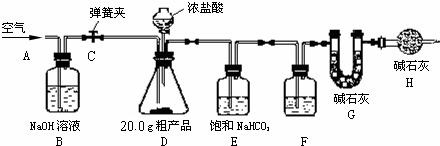
(1)该兴趣小组的同学设计了下图所示的实验装置.取20.0g粗产品,进行实验.
说明:①碱石灰是CaO与NaOH的固体混合物.
②E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生
的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O.
(2)操作步骤
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为4.8g.
(3)问题探究
①F中的试剂应为 .
②B装置的作用是 ,H装置的作用是 .
③若没有H装置,则测定的Na2CO3的质量分数会 (填“偏大”、“偏小”、“不变”).
事实上20.0g粗产品只能产生4.4g CO2.请你仔细分析上述实验,解释实验值4.8g比正确值4.4g偏大的原因(假设操作均正确) .
(4)数据计算
根据正确值4.4g可求得粗产品中Na2CO3的质量分数为 %.
NaOH含量的测定:
该小组同学又另取20.0g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为73g,放出CO2 4.4g(不考虑二氧化碳气体的溶解).求原粗产品中NaOH的质量分数.(写出计算过程)
 查看习题详情和答案>>
查看习题详情和答案>>
粗产品制备:
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
粗产品成分分析:
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质.
粗产品含量测定:
Na2CO3含量的测定:
(1)该兴趣小组的同学设计了下图所示的实验装置.取20.0g粗产品,进行实验.
说明:①碱石灰是CaO与NaOH的固体混合物.
②E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生
的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O.
(2)操作步骤
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为4.8g.
(3)问题探究
①F中的试剂应为
②B装置的作用是
③若没有H装置,则测定的Na2CO3的质量分数会
事实上20.0g粗产品只能产生4.4g CO2.请你仔细分析上述实验,解释实验值4.8g比正确值4.4g偏大的原因(假设操作均正确)
(4)数据计算
根据正确值4.4g可求得粗产品中Na2CO3的质量分数为
NaOH含量的测定:
该小组同学又另取20.0g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为73g,放出CO2 4.4g(不考虑二氧化碳气体的溶解).求原粗产品中NaOH的质量分数.(写出计算过程)
 查看习题详情和答案>>
查看习题详情和答案>>
(2011?镇江一模)课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定.
粗产品制备:
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为______.
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
粗产品成分分析:
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为______,该粗产品中一定不含有______,理由是______.
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质.
粗产品含量测定:
Na2CO3含量的测定:
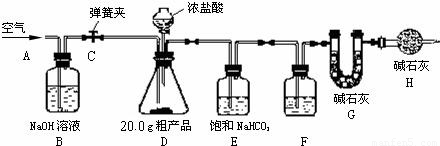
(1)该兴趣小组的同学设计了下图所示的实验装置.取20.0g粗产品,进行实验.
说明:①碱石灰是CaO与NaOH的固体混合物.
②E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生
的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O.
(2)操作步骤
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为4.8g.
(3)问题探究
①F中的试剂应为______.
②B装置的作用是______,H装置的作用是______.
③若没有H装置,则测定的Na2CO3的质量分数会______(填“偏大”、“偏小”、“不变”).
事实上20.0g粗产品只能产生4.4g CO2.请你仔细分析上述实验,解释实验值4.8g比正确值4.4g偏大的原因(假设操作均正确)______.
(4)数据计算
根据正确值4.4g可求得粗产品中Na2CO3的质量分数为______%.
NaOH含量的测定:
该小组同学又另取20.0g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为73g,放出CO2 4.4g(不考虑二氧化碳气体的溶解).求原粗产品中NaOH的质量分数.(写出计算过程)
查看习题详情和答案>>
粗产品制备:
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为______.
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
粗产品成分分析:
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为______,该粗产品中一定不含有______,理由是______.
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质.
粗产品含量测定:
Na2CO3含量的测定:
(1)该兴趣小组的同学设计了下图所示的实验装置.取20.0g粗产品,进行实验.
说明:①碱石灰是CaO与NaOH的固体混合物.
②E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生
的反应为:NaHCO3+HCl=NaCl+CO2↑+H2O.
(2)操作步骤
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为4.8g.
(3)问题探究
①F中的试剂应为______.
②B装置的作用是______,H装置的作用是______.
③若没有H装置,则测定的Na2CO3的质量分数会______(填“偏大”、“偏小”、“不变”).
事实上20.0g粗产品只能产生4.4g CO2.请你仔细分析上述实验,解释实验值4.8g比正确值4.4g偏大的原因(假设操作均正确)______.
(4)数据计算
根据正确值4.4g可求得粗产品中Na2CO3的质量分数为______%.
NaOH含量的测定:
该小组同学又另取20.0g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为73g,放出CO2 4.4g(不考虑二氧化碳气体的溶解).求原粗产品中NaOH的质量分数.(写出计算过程)

查看习题详情和答案>>