摘要:单质常温.常压下是气体.原子的L层有一个未成对的电子 +2价阳离子的核外电子排布与氖原子相同. (1)上表中与A属于同一周期的元素是 .写出D离子的电子排布式 .(2)D和C形成的化合物属于 晶体.写出C单质与水反应的化学方程式 .(3)对元素B的单质或化合物描述正确的是 . a.B元素的最高正价为+6 b.常温.常压下单质难溶于水 c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应(4)A和D两元素金属性较强的是 .写出能证明该结论的一个实验事实 .C.A.B.C.D.E均为有机化合物.它们之间的关系如图所示(提示:RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH.其中R和R'为烷基).
网址:http://m.1010jiajiao.com/timu_id_91574[举报]

半的部位及面积相等(任意两项,有其他合理的分析也可以)
(5)O2的释放量 CO2的吸收量
化学参考答案

(2)①发电厂;焦化厂;炼铁厂;水泥厂。
②Fe2O3+3CO 2Fe+3CO2;CaCO3+SiO2
2Fe+3CO2;CaCO3+SiO2 CaSiO3+CO2↑
CaSiO3+CO2↑

物理参考答案

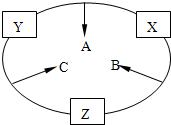 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知:B分子组成中Z原子个数比C分子中少一个,A是一种无色气体,遇空气变成红棕色.
请回答下列问题:
(1)元素Y在周期表中的位置为
第二周期、ⅤA族
第二周期、ⅤA族
.(2)物质C的电子式为
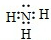
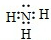
(3)X、Y、Z三种元素原子半径大小顺序为
N>O>H
N>O>H
(用元素符号表示).(4)B与C的稳定性大小顺序为
H2O>NH3
H2O>NH3
(用化学式表示).(5)C与X在一定条件下生成无色气体A的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.
已知:B分子组成中Z原子个数比C分子中少一个,A是一种无色气体,遇空气变成红棕色.
请回答下列问题:
(1)元素Y在周期表中的位置为______.
(2)物质C的电子式为______.
(3)X、Y、Z三种元素原子半径大小顺序为______(用元素符号表示).
(4)B与C的稳定性大小顺序为______(用化学式表示).
(5)C与X在一定条件下生成无色气体A的化学方程式______.
查看习题详情和答案>>
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.
已知:B分子组成中Z原子个数比C分子中少一个,A是一种无色气体,遇空气变成红棕色.
请回答下列问题:
(1)元素Y在周期表中的位置为______.
(2)物质C的电子式为______.
(3)X、Y、Z三种元素原子半径大小顺序为______(用元素符号表示).
(4)B与C的稳定性大小顺序为______(用化学式表示).
(5)C与X在一定条件下生成无色气体A的化学方程式______△4NO+6H2O
 查看习题详情和答案>>
查看习题详情和答案>>
已知:B分子组成中Z原子个数比C分子中少一个,A是一种无色气体,遇空气变成红棕色.
请回答下列问题:
(1)元素Y在周期表中的位置为______.
(2)物质C的电子式为______.
(3)X、Y、Z三种元素原子半径大小顺序为______(用元素符号表示).
(4)B与C的稳定性大小顺序为______(用化学式表示).
(5)C与X在一定条件下生成无色气体A的化学方程式______△4NO+6H2O
 查看习题详情和答案>>
查看习题详情和答案>>
现有原子序数小于10的三种非金属元素组成的甲、乙、丙、丁四种物质,它们之间存在如下的反应关系:甲+乙→丙+丁.其中甲在常温常压下是气体单质,乙和丙为气体,丁为液态,且甲、乙两分子所含电子数相等;乙、丙、丁均为由两种元素组成的共价化合物,三者分子中所含两种元素的原子个数比均为l:2.请回答下列问题:
(1)乙的结构式为______.
(2)甲+乙→丙+丁的化学方程式为______.
(3)将金属钠投入丁中可观察到的现象为______,发生反应的离子方程式为______.
(4)实验室制取丙的化学方程式为______.
查看习题详情和答案>>
在正常大气压、20℃条件下,水中溶解氧的量是9.17mg/L.当水体污染,溶解氧减少.因此溶解氧是评价环境水质的重要依据.我国《地面水环境标准》规定:生活饮用水源的溶解氧不能低于5mg/L.测定溶解氧的常用方法是碘量法.水中氧的含量测定步骤如下:
步骤1:水中溶解氧在碱性溶液中,将![]() 氧化为
氧化为![]() .
.
步骤2:加入碘离子,将![]() 再还原成
再还原成![]() .
.
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘.
(1)写出上面3步所涉及化学反应的离子方程式.
有关的测定数据如下:
①溶液的标定:取![]() 标准溶液(
标准溶液(![]() 溶液的浓度为178.8mg/L)与过量KI在酸性介质中反应,用
溶液的浓度为178.8mg/L)与过量KI在酸性介质中反应,用![]() 溶液滴定,消耗12.45mL.
溶液滴定,消耗12.45mL.
②取20.0℃下新鲜水样103.5mL,按上步骤滴定,消耗![]() 标准溶液11.80mL.已知该温度下的饱和
标准溶液11.80mL.已知该温度下的饱和![]() 含量为9.08mg/L.
含量为9.08mg/L.
③取20.0℃、密闭放置5天的水样102.2mL,按上述测定步骤滴定,消耗![]() 标准溶液6.75mL.
标准溶液6.75mL.
(2)计算![]() 标准溶液的浓度(单位:mol/L),写出计算过程.
标准溶液的浓度(单位:mol/L),写出计算过程.
(3)计算新鲜水样中氧的含量(单位:mol/L),写出计算过程.
(4)计算陈放水样中氧的含量(单位:mol/L),写出计算过程.
(5)用以上测定结果说明水样的性质.
查看习题详情和答案>>