摘要:2.下列仪器不可以用做反应容器的是A.试管 B.烧杯 C.量筒 D.锥形瓶
网址:http://m.1010jiajiao.com/timu_id_910888[举报]
实验室常用下列装置制取气体,请你根据所学知识回答下列问题.
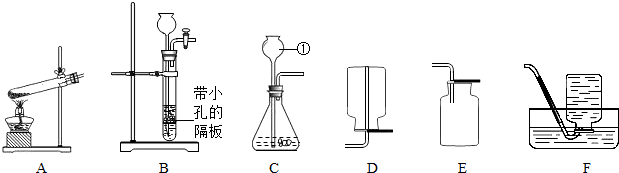
(1)写出编号所指仪器的名称:①________;
(2)以上装置图中共有两处明显的错误,请你找出错误的地方填在下列横线上:________.
将上述错误装置改进后,请继续回答下列问题.
(3)小亮利用上述装置制取氧气后发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?使用带火星的木条验满氧气的方法是否可靠呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,按要求收集气体.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二、三组实验,三组实验的数据和现象见下表.
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 3l | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
①为了达到实验目的小亮选用A和E装置制取和收集氧气并在A装置的试管口加一团棉花,请写出利用该装置制取氧气的化学反应方程式________.
②集气瓶中氧气的体积分数=收集的氧气占容积的体积分数+瓶中空气占容积的体积分数×________%.
③采取“半值法”探究能减少实验次数.例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验.同理,第二组实验可以省去的实验编号为________.
④小亮通过计算知道了使带火星的木条复燃的氧气浓度的最低值,同时发现使用带火星的木条验满氧气的方法并不可靠.
(4)你和小明还一起利用上述装置进行实验室制取二氧化碳的探究.
①选择药品.小明对三组药品进行了研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
②选择装置.通过对制取气体装置的分析,他选择用B或者C的发生装置.
③制取气体.将药品装入所选装置制取气体,欲制取2.2克的二氧化碳气体,则至少需要含杂质20%的石灰石多少克? 查看习题详情和答案>>
27、使用和选择实验装置,一方面要知道仪器的名称、用途和使用时的注意事项;另一方面要知道各种仪器组装的方法,更要懂得为什么要这样组装(即实验原理).下面是实验室用大理石与稀盐酸反应制取CO2的三个变化后的装置示意图,请仔细观察分析后回答下列问题.

(1)图二是在图一的基础上增加了仪器a,其名称叫
(2)如果需要制得较多量的二氧化碳气体,你可用
(3)实验室收集二氧化碳的方法叫
(4)图三是在图二的基础上增加了有孔塑料板c和活塞b,其优点是可以控制反应的发生和终止.在图三的启发下,小明利用底部有小洞的破试管,设计出了具有图三优点的装置(图A).
①若要制取二氧化碳气体,小明的实验操作是
②若隔离网改用铝丝做成的网,那生产生的后果是
查看习题详情和答案>>

(1)图二是在图一的基础上增加了仪器a,其名称叫
长颈漏斗;
;与图一比较,图二的优点是可随时添加反应液;
.(2)如果需要制得较多量的二氧化碳气体,你可用
锥形瓶
(填仪器名称)代替试管作反应容器.(可供选择的仪器有:量筒、烧杯、锥形瓶、烧瓶等).(3)实验室收集二氧化碳的方法叫
向上排气
集气法;检验二氧化碳已收满的方法是把燃着的木条放在集气瓶口,如果木条立即熄灭,则证明集满CO2
.(4)图三是在图二的基础上增加了有孔塑料板c和活塞b,其优点是可以控制反应的发生和终止.在图三的启发下,小明利用底部有小洞的破试管,设计出了具有图三优点的装置(图A).
①若要制取二氧化碳气体,小明的实验操作是
把试管浸入酸溶液中;
;若要停止制取,小明的实验操作是把试管从酸溶液中移出来
.②若隔离网改用铝丝做成的网,那生产生的后果是
产生的CO2中混有H2而不纯净
;其原因是铝丝与盐酸反应生成H2
.某研究性学习小组的同学在用硫酸溶液处理废锌片时发现产生的气体具有刺激性气味,同时发现试管外壁发烫,这种现象引起同学们的思考和研究.
查阅资料:①SO2溶于水,它能与NaOH反应,生成Na2SO3;②H2具有还原性.
分析讨论:根据试管发烫的现象分析,说明锌与硫酸发生的反应是 (填“吸热”或“放热”)反应.
提出猜想:对生成的气体进行猜想:
猜想1:可能是H2;
猜想2:可能是SO2,做出此猜想的理由是 ;
猜想3:可能是H2和SO2的混合气体.
实验方案:研究性学习小组的同学设计了图1所示的装置进行探究(夹持仪器已省略,假设装置中的反应都进行完全)
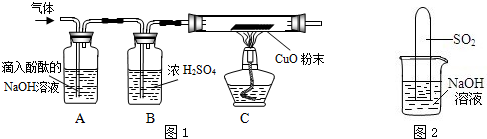
问题讨论:(1)如果装置A没有明显实验现象,装置C的现象为 ,则猜想1成立.
(2)如果装置A的现象为溶液红色变浅,装置C没有明显实验现象,则猜想 成立.
(3)猜想3成立的实验现象是 .
(4)装置B中浓硫酸的作用是 .
实验反思:(1)实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是 .
(2)小组内一同学又设计了判断SO2与NaOH溶液能否发生反应的装置(如图2),实验时发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论,其他同学认为这一结论不严谨,理由是 .要得到科学严谨的结论,仍利用该装置,需做的对比实验 .
拓展延伸:小组的同学欲证明试管内锌与硫酸反应后的溶液中是否有硫酸剩余,下列方法中错误的是 (填序号).
①往容器内再加稀盐酸,如有气泡产生,则溶液中没有硫酸
②往容器内再加锌粒,如有气泡产生,则溶液中一定有硫酸
③往容器内加氯化钡溶液,如有沉淀生成,则溶液中一定有硫酸
④将试管中剩余固体加入到硫酸铜溶液中,如有红色固体生成,则溶液中没有硫酸.
查看习题详情和答案>>
查阅资料:①SO2溶于水,它能与NaOH反应,生成Na2SO3;②H2具有还原性.
分析讨论:根据试管发烫的现象分析,说明锌与硫酸发生的反应是
提出猜想:对生成的气体进行猜想:
猜想1:可能是H2;
猜想2:可能是SO2,做出此猜想的理由是
猜想3:可能是H2和SO2的混合气体.
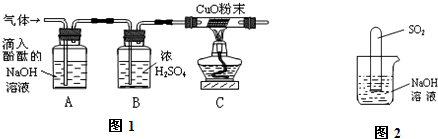
实验方案:研究性学习小组的同学设计了图1所示的装置进行探究(夹持仪器已省略,假设装置中的反应都进行完全)

问题讨论:(1)如果装置A没有明显实验现象,装置C的现象为
(2)如果装置A的现象为溶液红色变浅,装置C没有明显实验现象,则猜想
(3)猜想3成立的实验现象是
(4)装置B中浓硫酸的作用是
实验反思:(1)实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是
(2)小组内一同学又设计了判断SO2与NaOH溶液能否发生反应的装置(如图2),实验时发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论,其他同学认为这一结论不严谨,理由是
拓展延伸:小组的同学欲证明试管内锌与硫酸反应后的溶液中是否有硫酸剩余,下列方法中错误的是
①往容器内再加稀盐酸,如有气泡产生,则溶液中没有硫酸
②往容器内再加锌粒,如有气泡产生,则溶液中一定有硫酸
③往容器内加氯化钡溶液,如有沉淀生成,则溶液中一定有硫酸
④将试管中剩余固体加入到硫酸铜溶液中,如有红色固体生成,则溶液中没有硫酸.
 在生产生活中,你会发现“化学就在身边”.
在生产生活中,你会发现“化学就在身边”.