摘要:16.有人在研究FeSO4受热分解时.作了如下假设: (1)假设它按KClO3受热分解的方式来分解.反应的化学方程式为 ,(2)假设它按CaCO3受热分解的方式来分解.反应的化学方程式为 ,(3)事实上由于FeO易被氧化.FeSO4的分解产物(分解温度约500℃)是Fe2O3.SO2和SO3.反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu_id_908850[举报]
有人在研究硫酸亚铁(FeSO4)受热分解反应时,作了两种假设:
(1)假设它按照氯酸钾受热分解的方式来分解,反应方程式为: ;
(2)假设它按照碳酸钙受热分解的方式来分解,反方程式为: ;
(3)事实上,由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3(分解温度在500℃左右),反应的方程式是 .
查看习题详情和答案>>
(1)假设它按照氯酸钾受热分解的方式来分解,反应方程式为:
(2)假设它按照碳酸钙受热分解的方式来分解,反方程式为:
(3)事实上,由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3(分解温度在500℃左右),反应的方程式是
(2013?广陵区一模)现有下列装置,回答问题:
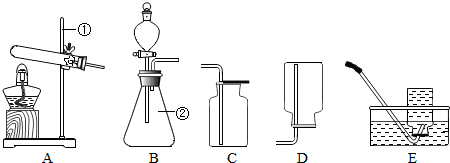
(1)写出有标号仪器的名称:①
(2)检查B装置的气密性的方法是:堵住右侧导气管,
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为
(4)实验室用KMnO4制取O2,选用的收集装置为
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
[实验内容]:
[实验分析]:
①完善上表中的填空内容:a
②实验2的目的是
③经讨论,实验1的结论不正确,理由是
[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
KMnO2+O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以
查看习题详情和答案>>

(1)写出有标号仪器的名称:①
铁架台
铁架台
;②锥形瓶
锥形瓶
;(2)检查B装置的气密性的方法是:堵住右侧导气管,
打开分液漏斗活塞
打开分液漏斗活塞
,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
发生装置为
| ||
B
B
,;(4)实验室用KMnO4制取O2,选用的收集装置为
C或E
C或E
;(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a a (H2O2质量分数)的H2O2溶液中 |
平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b b |
[实验分析]:
①完善上表中的填空内容:a
6%
6%
、bKMnO4分解后的产物中没有MnO2
KMnO4分解后的产物中没有MnO2
;②实验2的目的是
和实验1进行对比,确定MnO2是否为起催化作用
和实验1进行对比,确定MnO2是否为起催化作用
;③经讨论,实验1的结论不正确,理由是
可能是分解后产物中其他物质起催化作用
可能是分解后产物中其他物质起催化作用
;[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4
| ||
| ||
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
C
C
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以
b
b
(填“a”或“b”)为主.
有人在研究硫酸亚铁受热分解反应时,做了两种假设:
(1)假设它按KClO3受热分解的方式来分解,反应方程式为 .
(2)假设它按CaCO3受热分解的方式来分解,反应方程式为 .
(3)事实上,由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2和SO3(分解温度在500℃左右),反应方程式是 .
查看习题详情和答案>>
(1)假设它按KClO3受热分解的方式来分解,反应方程式为
(2)假设它按CaCO3受热分解的方式来分解,反应方程式为
(3)事实上,由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2和SO3(分解温度在500℃左右),反应方程式是
现有下列装置,回答问题: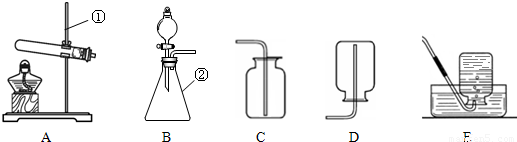
(1)写出有标号仪器的名称:① ;② ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 发生装置为 ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
[实验内容]:
[实验分析]:
①完善上表中的填空内容:a 、b ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4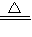 2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4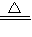 KMnO2+O2↑
KMnO2+O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 (填“a”或“b”)为主. 查看习题详情和答案>>

(1)写出有标号仪器的名称:① ;② ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 发生装置为 ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 |
[实验分析]:
①完善上表中的填空内容:a 、b ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4
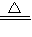 2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4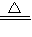 KMnO2+O2↑
KMnO2+O2↑Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 (填“a”或“b”)为主. 查看习题详情和答案>>