摘要:26.加热3.40克某银盐使它完全分解.得到2.16克银.0.92克NO2.0.32克O2.求该银盐中银.氮.氧三种元素的质量比是多少?氧元素的质量分数是多少?
网址:http://m.1010jiajiao.com/timu_id_906897[举报]

仔细查阅上表资料,上述方案最可行的是_____(填序号代码)。
(3)根据化学方程式计算:加热2.22gCuCO3·Cu(OH)2,使之完全分解,计算剩余固体的质量______。
(4)工业上以黄铜矿为原料生产铜时会产生SO2尾气。将SO2直接排入到大气中,溶于雨水会形成_________;处理该尾气一般是将SO2循环制备成H2SO4,用氨水吸收,H2SO4与氨水反应生成的铵盐是一种常见氮肥,该盐是________(写化学式或名称)。
查看习题详情和答案>>
(3)根据化学方程式计算:加热2.22gCuCO3·Cu(OH)2,使之完全分解,计算剩余固体的质量______。
(4)工业上以黄铜矿为原料生产铜时会产生SO2尾气。将SO2直接排入到大气中,溶于雨水会形成_________;处理该尾气一般是将SO2循环制备成H2SO4,用氨水吸收,H2SO4与氨水反应生成的铵盐是一种常见氮肥,该盐是________(写化学式或名称)。
为确定氨的组成,在一定温度、压强下进行如下实验:取20 mL氨,设法使它完全分解为N2和H2,体积为40 mL。加入20 mL O2,当H2和O2完全化合成水,剩余气体体积为15 mL(已知一定温度、压强下一定体积各种气体中的分子数相同)。请根据以上数据确定氨的分子式。
查看习题详情和答案>>(2013?广陵区一模)现有下列装置,回答问题:
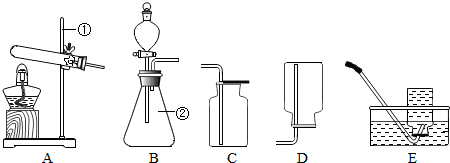
(1)写出有标号仪器的名称:①
(2)检查B装置的气密性的方法是:堵住右侧导气管,
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为
(4)实验室用KMnO4制取O2,选用的收集装置为
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
[实验内容]:
[实验分析]:
①完善上表中的填空内容:a
②实验2的目的是
③经讨论,实验1的结论不正确,理由是
[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
KMnO2+O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以
查看习题详情和答案>>

(1)写出有标号仪器的名称:①
铁架台
铁架台
;②锥形瓶
锥形瓶
;(2)检查B装置的气密性的方法是:堵住右侧导气管,
打开分液漏斗活塞
打开分液漏斗活塞
,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
发生装置为
| ||
B
B
,;(4)实验室用KMnO4制取O2,选用的收集装置为
C或E
C或E
;(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a a (H2O2质量分数)的H2O2溶液中 |
平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b b |
[实验分析]:
①完善上表中的填空内容:a
6%
6%
、bKMnO4分解后的产物中没有MnO2
KMnO4分解后的产物中没有MnO2
;②实验2的目的是
和实验1进行对比,确定MnO2是否为起催化作用
和实验1进行对比,确定MnO2是否为起催化作用
;③经讨论,实验1的结论不正确,理由是
可能是分解后产物中其他物质起催化作用
可能是分解后产物中其他物质起催化作用
;[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4
| ||
| ||
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
C
C
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以
b
b
(填“a”或“b”)为主.
菠菜营养丰富,素有“蔬菜之王”的美称.民间流传:菠菜豆腐同食,易得结石.某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行了探究.
[查阅资料]①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐.
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等.
[提出猜想]“菠菜豆腐不能同食”的原因可能是 .
[探究一]菠菜中部分成分分析
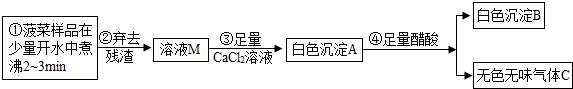
(1)步骤③中加入足量的CaCl2溶液的目的 .
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式 .沉淀A、B的质量关系为:m(A) m(B)(填“>”、“<”或“=”).
(3)白色沉淀B的化学式为 ,由此可见菠菜豆腐不能同食.以下饮食观点正确的是 (填字母)
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
[探究二]某草酸钙晶体(CaC2O4?xH2O)热分解研究按如图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
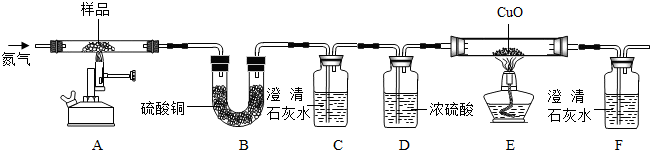 (4)①反应开始前通入氮气的目的是 .
(4)①反应开始前通入氮气的目的是 .
②装置B中硫酸铜粉末变蓝,说明产物中有 ,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物还有 和 ,经检验A中残留固体为氧化物.
③对上述装置从环保角度提一个改进建议 .
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4?xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系如图.
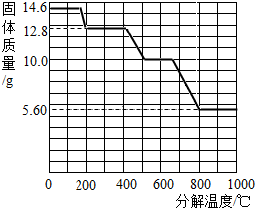
固体质量--分解温度关系图
①800℃以上时,固体成分的化学式为 .
②计算CaC2O4?xH2O中的x(写出计算过程,CaC2O4的相对分子质量:128).
③残留固体为CaC2O4时的温度范围 ,写出固体质量由12.8g变为10.0g时的化学方程式 .
查看习题详情和答案>>
[查阅资料]①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐.
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等.
[提出猜想]“菠菜豆腐不能同食”的原因可能是
[探究一]菠菜中部分成分分析

(1)步骤③中加入足量的CaCl2溶液的目的
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式
(3)白色沉淀B的化学式为
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
[探究二]某草酸钙晶体(CaC2O4?xH2O)热分解研究按如图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
 (4)①反应开始前通入氮气的目的是
(4)①反应开始前通入氮气的目的是②装置B中硫酸铜粉末变蓝,说明产物中有
③对上述装置从环保角度提一个改进建议
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4?xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系如图.

固体质量--分解温度关系图
①800℃以上时,固体成分的化学式为
②计算CaC2O4?xH2O中的x(写出计算过程,CaC2O4的相对分子质量:128).
③残留固体为CaC2O4时的温度范围
