网址:http://m.1010jiajiao.com/timu_id_899601[举报]
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。
他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
① 可能是NaOH; ② 可能是Na2CO3; ③ 可能是NaOH与Na2CO3的混合物。
为了验证猜想,他们分别做了下面的实验。
(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军认为白色粉末是NaOH。请判断小刚所得结论是否正确,并简述理由。_______,
____________________________________________________________________。
(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有______。为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤。你认为她接下来还应进行的实验是____________________________________________________;
在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由。_________,_______________________________________________________。
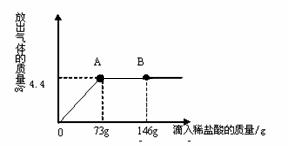
(3)在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加43.1g水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
 |
请根据题意回答问题:
(H-1;Cl-35.5;Na-23;C-12;O-16)
①当滴加了73g稀盐酸时,放出气体的质量
为 g。
②当滴加稀盐酸至图中B点时,烧杯中溶液
里的溶质是(写化学式) 。
③当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数。[计算结果保留一位小数](2分)
查看习题详情和答案>>(7分)某同学进行试验探究时,欲配制10%的Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在未溶物。为探究原因,该同学查得Ba(OH)2在20℃时的溶解度2.1 g。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
 步骤2:取适量滤液于试管中,滴加稀硫酸。 步骤2:取适量滤液于试管中,滴加稀硫酸。 | 有 ① 生成,说明有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 | 试管中有 ②生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
| 步骤4:取适量滤液于试管中, ④ 。 | 试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
五、计算与分析题(共2小题,共10分)
目前已制得的纯金属只有90余种,但由这些纯金属按一定组成和质量比制得的合金已达几千种。由于合金更容易适合不同的用途,因此被大量应用于日常生活、工农业及科学研究中。结合所学知识,完成27、28题。 查看习题详情和答案>>
(7分)某同学进行试验探究时,欲配制10%的Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在未溶物。为探究原因,该同学查得Ba(OH)2在20℃时的溶解度2.1 g。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
|
步骤2:取适量滤液于试管中,滴加稀硫酸。 |
有 ① 生成,说明有Ba2+ |
|
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 |
试管中有 ② 生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
|
步骤4:取适量滤液于试管中, ④ 。 |
试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
(3)在20℃室温下, (填“能”或“不能”) 配制10%的Ba(OH)2溶液。
五、计算与分析题(共2小题,共10分)
目前已制得的纯金属只有90余种,但由这些纯金属按一定组成和质量比制得的合金已达几千种。由于合金更容易适合不同的用途,因此被大量应用于日常生活、工农业及科学研究中。结合所学知识,完成27、28题。
查看习题详情和答案>>
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
材料2:四种盐在不同温度下的溶解度表.
| 温度 盐 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)在实验室中,你选择的制备C02反应的化学方程式为.在工业生产中,要获得生产纯碱的原料CO2你认为最经济实用的方法是以为原料,该反应的化学方程式为.
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是.
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是.
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同.).在③中,将析出的晶体过滤后,溶液中数量减少的离子有;滤液中仍然存在的离子有.②中反应的化学方程式为.
(5)在20℃时,向含NH4HC03 21g的饱和溶液中加入足量食盆.试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH4HC03:79; NaCl:58.5; NaHC03:84,NH4CI:53.5). 查看习题详情和答案>>