网址:http://m.1010jiajiao.com/timu_id_895352[举报]
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
查看习题详情和答案>>
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
查看习题详情和答案>>
【提出猜想】猜想一:没有变质,只有CaO和NaOH两种固体;
猜想二:已完全变质,碱石灰全部变成了CaCO3和Na2CO3。
【实验探究】实验过程与现象如下图所示:
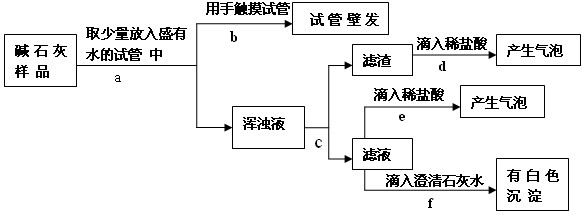
(2)操作f中发生反应的化学方程式为_______________;由操作e、f中的现象可判断滤液里含有_________(填化学式),由此判断猜想一________(填“成立”或 “不成立”)。
(3)综合(1)、(2)中的结论,判断该碱石灰的变质情况为_______________。
【拓展应用】(4)由上述实验说明,在实验室存放碱石灰应__________保存。
【提出猜想】猜想一:没有变质,只有CaO和NaOH两种固体; 猜想二:已完全变质,碱石灰全部变成了CaCO3和Na2CO3.
【实验探究】实验过程与现象如下图所示:
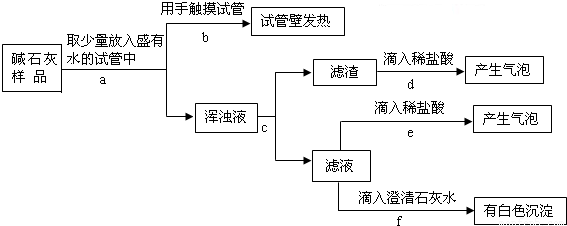
【做出判断】(1)若把Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,侧由操作b中的现象可判断猜想二(填“成立”或“不成立”).
(2)操作f中发生反应的化学方程式为;
由操作e、f中的现象可判断滤液里含有(填化学式),由此判断猜想一(填“成立”或“不成立”).
(3)综合(1)、(2)中的结论,判断该碱石灰的变质情况为.
【拓展应用】(4)由上述实验说明,在实验室存放碱石灰应保存. 查看习题详情和答案>>
【提出猜想】猜想一:没有变质,只有CaO和NaOH两种固体; 猜想二:已完全变质,碱石灰全部变成了CaCO3和Na2CO3.
【实验探究】实验过程与现象如下图所示:
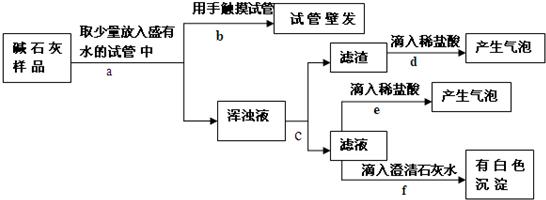
【做出判断】(1)若把Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,侧由操作b中的现象可判断猜想二
(2)操作f中发生反应的化学方程式为
由操作e、f中的现象可判断滤液里含有
(3)综合(1)、(2)中的结论,判断该碱石灰的变质情况为
【拓展应用】(4)由上述实验说明,在实验室存放碱石灰应