摘要:17.为制备少量的氧气.某化学研究性小组开展了如下一系列研究工作. [查阅资料]:通过查阅资料得知:双氧水.氯酸钾.高锰酸钾等物质在一定的条件下都可以分解产生氧气.其中.双氧水价格最低.在常温下就能够分解放出氧气.该反应无副产物,氯酸钾价格较高.分解较困难.且常伴有副产物,高锰酸钾价格较高.加热即可快速分解放出氧气.二氧化锰对上述三种物质的分解都能起催化作用.根据上述信息.该小组选择了双氧水和二氧化锰混合制取氧气.[组装仪器]:选择下列实验仪器.安装实验装置.进行制备实验.
网址:http://m.1010jiajiao.com/timu_id_895143[举报]
为制备少量的氧气,某化学研究性小组开展了如下一系列研究工作。
[查阅资料]:通过查阅资料得知:双氧水、氯酸钾、高锰酸钾等物质在一定的条件下都可以分解产生氧气。其中,双氧水价格最低,在常温下就能够分解放出氧气,该反应无副产物;氯酸钾价格较高,分解较困难,且常伴有副产物;高锰酸钾价格较高,加热即可快速分解放出氧气。二氧化锰对上述三种物质的分解都能起催化作用。根据上述信息,该小组选择了双氧水和二氧化锰混合制取氧气。
[组装仪器]:选择下列实验仪器,安装实验装置,进行制备实验。
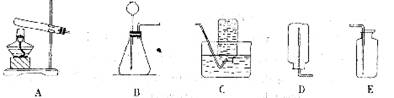
[实验操作]:进行实验完毕后,洗刷实验仪器,整理实验用品。
根据上述实验,请回答下列问题:
(1)要制取并收集一瓶氧气,应选择的实验装置是 (填写字母代号)。在组装好实验装置后,首先要进行 。
(2)有气体生成的化学反应,若在有限空间里发生时,如果反应过快,容易引起爆炸。你认为可以采取哪些措施预防爆炸?(列举一条)
(3)在选择药品时,除应考虑药品价格外,还应考虑哪些问题?(列举两条)
① ;
② 。
查看习题详情和答案>>(2006?扬州)下面是某研究性学习小组展示的关于《温室效应研究》课题的部分资料及图片
请回答下列问题:
(1)该研究性学习小组,采用图①装置制备CO2气体.制备反应的化学方程式为
(2)图②装置研究产生温室效应的气体的化学式是
(3)该小组用图③装置来进行CO2产生温室效应的模拟研究,在左侧集气瓶中盛放CO2气体,右侧集气瓶中盛放
(4)地球只有一个,为了明天有一个美好的家园,人类应该倍加爱护她.请提出两点减缓温室效应的建议
查看习题详情和答案>>
| ?温室气体还有哪些? ?人类的哪些活动造成大气温室气体增多? ?怎样才能减少大气中的温室气体,从而减缓地球的温室效应? | 什么是温室效应? 温室效应是怎么来的? 温室效应是由于大气中的大量二氧化碳、氟氯烃、甲烷、二氧化氮等温室气体(其中主要是CO2),像玻璃罩一样,紧紧地罩在我们的上空,使太阳照射在地球上的热量无法逸散,从而使气候圈增温的现象. 目前,产生温室效应主要同由于现代工业社会过多燃烧煤炭、石油和天然气以及森林大火等等这些燃料燃烧后放出大量的二氧化碳气体进入大气造成的 |  |
 |  |
(1)该研究性学习小组,采用图①装置制备CO2气体.制备反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑.
CaCO3+2HCl=CaCl2+H2O+CO2↑.
.(2)图②装置研究产生温室效应的气体的化学式是
CH4
CH4
,该小组需要定时观测并记录的数据是温度
温度
.(3)该小组用图③装置来进行CO2产生温室效应的模拟研究,在左侧集气瓶中盛放CO2气体,右侧集气瓶中盛放
空气
空气
(填气体名称).设计意图:希望实验时,能观察到食用油a侧液面高度低于
低于
(填“低于”、“等于”或“高于”)b侧液面高度,以此证明CO2是产生温室效应的气体.(4)地球只有一个,为了明天有一个美好的家园,人类应该倍加爱护她.请提出两点减缓温室效应的建议
减少煤和石油的燃烧或开发新燃料,如汽车多采用乙醇汽油
减少煤和石油的燃烧或开发新燃料,如汽车多采用乙醇汽油
、植树造林,绿化荒山
植树造林,绿化荒山
.
过碳酸钠广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:
[资料卡片]:
Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>
[资料卡片]:
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>
过碳酸钠广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:
[资料卡片]:
Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>
[资料卡片]:
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>
过碳酸钠广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:
[资料卡片]:
Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>
[资料卡片]:
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>