网址:http://m.1010jiajiao.com/timu_id_88957[举报]
二、选择题(本题包括8小题。每小题给的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错或不答的得0分)
l4 ACD 15 B
----理科综合.files/image083.gif)
22.(17分)(1)C 6分
(2)?如下图所示.(5分)
?----理科综合.files/image085.gif) (或
(或----理科综合.files/image087.gif) )(4分)
)(4分)
----理科综合.files/image089.gif) 和
和----理科综合.files/image091.gif) ;
; ----理科综合.files/image093.gif) 和
和----理科综合.files/image095.gif) 分别表示第一次测量和第二次测量电阻箱和电压表读数;(3分)
分别表示第一次测量和第二次测量电阻箱和电压表读数;(3分)
23.( 16 分)解析:(1)----理科综合.files/image097.gif) ①
①
----理科综合.files/image099.gif) ②
②
(2)----理科综合.files/image101.gif) ③
③
----理科综合.files/image103.gif) ④
④
(3)----理科综合.files/image105.gif) ⑤
⑤
评分参考:①③④⑤式分别得3分, ②得4分
24.(19分)解:从原点沿x轴直线射出过程匀速直线运动,受力平衡:
----理科综合.files/image107.gif) ①
①
当撒去电场,在匀强磁场中匀速圆周运动,如图所示,设半径为r
----理科综合.files/image109.gif) 在
在----理科综合.files/image111.gif) 内有:
内有:----理科综合.files/image113.gif) ②
②
----理科综合.files/image115.gif) ③
③
若撤去磁场,只保留电场,带电粒子向上偏转,做类平抛运动,从f点射出:
----理科综合.files/image117.gif) ④
④
----理科综合.files/image119.gif) ⑤
⑤
----理科综合.files/image121.gif) ⑥
⑥
由①②③④⑤式得:
----理科综合.files/image123.gif) ⑦
⑦
该粒子从ab边射出,距a点距离----理科综合.files/image125.gif)
评分参考:①③④⑤⑥式分别得3分,②⑦式得2分
25.(25分)(1)对a、b棒水平轨道分析,动量守恒;----理科综合.files/image127.gif) 是稳定时a、b棒共同速度
是稳定时a、b棒共同速度
----理科综合.files/image129.gif) ①
①
----理科综合.files/image131.gif) ②
②
损失的机械能为----理科综合.files/image133.gif)
----理科综合.files/image135.gif)
----理科综合.files/image137.gif) ③
③
(2)由于b棒在冲上又返回过程中,机械能守恒,返回时速度大小不变
----理科综合.files/image139.gif) ④
④
b棒与a棒向右运动过程中,直到稳定,动量守恒
----理科综合.files/image141.gif) ⑤
⑤
达到新的稳定状态a,b的末速度:
----理科综合.files/image143.gif) ⑥
⑥
(3)整个过程中产生的内能等于系统机械能的减少量
----理科综合.files/image145.gif) ⑦
⑦
----理科综合.files/image147.gif) ⑧
⑧
评分参考:①式3分,得出②式得1分;③式4分④式得2分;⑤得3分得出⑥得2分;⑦式得3分由以上式得出⑧式得2分.解法不同,最后结果相同只要正解,同样给分.
化学部分答案
6-13 B C D B D A C A
26、⑴ 三角锥型(1分) 使湿润的红色石蕊试纸变蓝(1分,其它合理答案均可)
⑵4OH--― 4e--=O2↑+2H2O(2分)
⑶4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分) Fe2O3+2Al----理科综合.files/image149.jpg) 2Fe+Al2O3
(2分)
2Fe+Al2O3
(2分)
⑷Fe+4H++NO3--=Fe3++NO↑+2H2O(2分)⑸(NH4)2Fe(SO4)2 (3分)
⑹ H2(g)+1/2 O2(g)==H2O(l);△H=-2b/a KJ/mol (2分)
27、(1)----理科综合.files/image151.jpg) (2分)
(2分) ----理科综合.files/image153.jpg) (2分)
(2分)
(2)N2H4 (2分) H2O2 (2分)
(3)Cl2+H2O2=2HCl+O2↑(答HClO+H2O2=HCl+O2↑+H2O可得分);(2分)
(4)①NH4Cl(或NH4NO3) (2分),NaOH (2分);②c(Cl−)>c(NH4+)>c(Na+)>c(OH−)>c(H+)
(或c(NO3−)>c(NH4+)>c(Na+)>c(OH−)>c(H+))(2分)
28、(1) C8H8O3(2分)
----理科综合.files/image155.jpg)
(2) (2分)
----理科综合.files/image157.jpg)
(2分)
----理科综合.files/image159.jpg)
(3)(只写出两种,每个2分)
----理科综合.files/image161.jpg)
(4) (2分)
(5)有利于控温,均匀受热,减少副反应发生(2分)
(6)解析: C8H8O3 + 8.5 O2 == 8 CO2 + 4H2O;C6H6O + 7 O2 == 6 CO2 + 3 H2O
8x + 6 ( n?x ) == a/ 22.4
x =a/ 44.8?3 n [或 x =b / 18?3 n] (3分)
29、 [探究一]
[探究二] (1)不需要(2分) (2)检查装置的气密性(或合金完全溶解,或加入足量盐酸,或调整
量气管C的高度,使C中液面与B液面相平等合理答案) (2分)
[探究三](1)灼烧后固体的质量 (2分) (2)是 (2分)
生物部分答案
2009届高三生物月考答案
生物月考4答案
一、单项选择题:(每题6分,共5题30分)
1.C 2.D 3.B 4.A 5.C
二、非选择题:
30、Ⅰ.(每空2分,共10分)⑴有氧呼吸、无氧呼吸 体内储存的高能物质的分解。
⑵氧气(或有氧呼吸供给能量)。⑶血液中含有多对缓冲物质,可使血液pH保持稳定。
Ⅱ. (每空2分,共12分)
方法步骤:①向培养皿中倒入适量的水,将等量的种子分别放入两组培养皿中。
②将一组置于有光环境中,另一组置于黑暗环境中。
③在培养过程中,使两组所处温度、水分、空气等状况相同且适宜。
可能的实验结果及相应的结论:
①有光组萌发,无光组也萌发(或答发芽率无显著差异)。该种植物种子萌发不受光的影响。
②有光组萌发,无光组不萌发(或答有光组发芽率高于无光组,差异显著)。光是该种植物种子萌发的必要条件之一。
③有光组不萌发,无光组萌发(或答无光组发芽率高于有光组,差异显著)。光抑制该种植物种子的萌发。
31、(每空2分,共20分)
⑴受精作用,受精极核。⑵有性生殖,变态发育。⑶同源染色体联会、交叉互换;同源染色体分离、非同源染色体自由组合。(答不全得一半分数)⑷2 相同。⑸AbD或Abd或abD或abd。(错答和漏答均不得分)
⑹AB aabb.
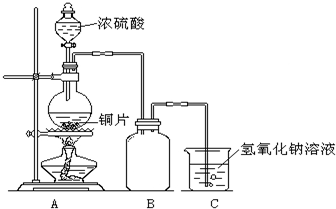
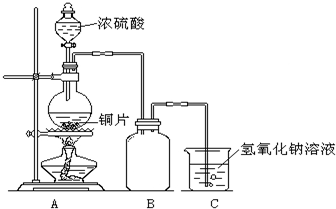 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:
| ||
| ||
实验中若有m g铜参加了反应,则有
| m |
| 64 |
| m |
| 64 |
| m |
| 32 |
| m |
| 32 |
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一
方案二
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)
| V |
| 22.4×0.012 |
| V |
| 22.4×0.012 |

(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_______________________,实验中若有mg铜参加了反应,则有
________mol硫酸被________(填“氧化”或“还原”),电子转移数目为________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是________________________。
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案一、二均不可取,请你说出原因?
方案一:________________________________;
方案二:________________________________;
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)________。
请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:______,
实验中若有mg铜参加了反应,则有______mol硫酸被______(填“氧化”或“还原”),转移电子的物质的量为______mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是______(填写字母编号).
A.硫酸钠溶液B.氯化钡溶液C.银粉D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是______
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为VL(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一______;
方案二______.
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)______.
设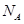 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
A.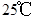 时,1g水中约含有6.02×1013个OH-
时,1g水中约含有6.02×1013个OH-
B.在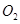 参与的反应中,
参与的反应中,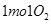 作氧化剂时得到的电子数一定是
作氧化剂时得到的电子数一定是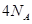
C.1.8g重水(D2O)中含NA个质子和NA个中子
D.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
查看习题详情和答案>>
设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
A.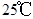 时,1g水中约含有6.02×1013个OH- 时,1g水中约含有6.02×1013个OH- |
B.在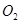 参与的反应中, 参与的反应中,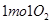 作氧化剂时得到的电子数一定是 作氧化剂时得到的电子数一定是 |
| C.1.8g重水(D2O)中含NA个质子和NA个中子 |
| D.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA |