摘要:1.第Ⅱ卷共8页.用蓝.黑色钢笔或圆珠笔直接答在试卷上.作图题也可用铅笔做答.
网址:http://m.1010jiajiao.com/timu_id_888519[举报]
对生活中的下列现象,解释不合理的是( )
A.25m3的石油气在加压的情况下可装入容积为0.024m3的钢瓶中——分子间有间隔
|
C.古代书法(用碳黑等制成的墨书写)保存至今不变色——常温下碳的化学性质稳定
D.沙漠地区的铁制品锈蚀较慢——沙漠地区缺少氧气
查看习题详情和答案>>
请根据下列装置,回答问题: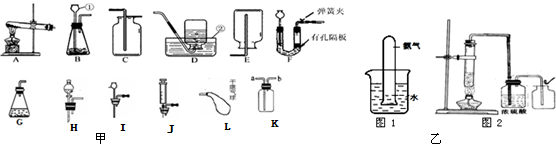
(1)写出甲图中标号①和②的仪器名称
(2)在甲图装置B中仪器①的下端管口要浸在液面下,是为了
(3)实验室加热暗紫色固体制取O2的反应符号表达式为
(4)若用装置C、D或K收集O2,要使收集O2干燥且纯净,则应选
(5)用过氧化氢溶液与二氧化锰制取O2,装置G虽然操作简便,但要得到平稳的气流,从H、I、J中选取
(6)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是
a.烘干 b.溶解 c.过滤 d.洗涤
(7)实验室利用F装置制备氢气,事先将锌粒放于有孔隔板之上,然后从另一端加入稀盐酸,装置F相对于装置B制备氢气,具有的优点是
(8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物的方法制取氨气(NH3),同时还生成氯化钙(CaCl2)和水,则该反应的符号表达式为
(9)某化学小组在学习了制取O2后,他们发现在实验室里用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是
为了验证此猜想是否正确,兴趣小组的同学经过热烈讨论,制定了实验方案如乙图图2并进行了实验.
第一组同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,一段时间后,用带火星的木条检验,木条复燃;
第二组同学在5%的H2O2溶液中加入2滴新制氢氧化钠溶液,加热一段时间后,用带火星木条检验,木条复燃;
第三组同学从实验装置上进行了改进,效果很好(见乙图图2).
在实验基础上,同学们经过交流讨论,得出了一些结论:
①由第一组实验可得出影响H2O2分解产生O2多少及快慢的因素之一是
②由第二组实验可分析得出氢氧化钠所起的作用可能是
③第三组实验验证了实验前同学们猜想的正确性.其中浓硫酸的作用是
④小李同学认真观察了第三组同学的实验装置,提出了一种简单的改进装置,经现场实验,效果很好,请你说出他改进的地方:
查看习题详情和答案>>

(1)写出甲图中标号①和②的仪器名称
长颈漏斗、水槽
长颈漏斗、水槽
.(2)在甲图装置B中仪器①的下端管口要浸在液面下,是为了
防止气体从长颈漏斗逸出
防止气体从长颈漏斗逸出
.(3)实验室加热暗紫色固体制取O2的反应符号表达式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,若用排水法收集气体,当观察到
| ||
气泡连续均匀时
气泡连续均匀时
时才开始收集;停止实验时,应该先将导管移出水面,后熄灭酒精灯
先将导管移出水面,后熄灭酒精灯
,否则水倒吸回试管使试管冷热不均而炸裂
水倒吸回试管使试管冷热不均而炸裂
.(4)若用装置C、D或K收集O2,要使收集O2干燥且纯净,则应选
D
D
装置.若用排水法收集到的O2不纯,可能的原因是?(两条)集气瓶未事先装满水
集气瓶未事先装满水
、未等气泡连续均匀就开始收集
未等气泡连续均匀就开始收集
.若用向上排空气法收集氧气,如何验满?将带火星木条横放瓶口,若木条复燃则已收集满
将带火星木条横放瓶口,若木条复燃则已收集满
.实验过程中发现水槽中的水变成了浅紫红色,可能的操作原因:试管口未塞棉花
试管口未塞棉花
.(5)用过氧化氢溶液与二氧化锰制取O2,装置G虽然操作简便,但要得到平稳的气流,从H、I、J中选取
H或J
H或J
取代G中的单孔塞,以达到目的.若选用H与锥形瓶组装的发生装置,当反应停止时,集气瓶中还差少量O2,为集满O2,在不拆卸装置的前提下,可以从分液漏斗往锥形瓶中加入少量双氧水
从分液漏斗往锥形瓶中加入少量双氧水
、用热毛巾捂住锥形瓶
用热毛巾捂住锥形瓶
.实验结束后,该同学发现收集到的气体比预计的少很多,百思不得其解.你认为可能的原因是:过氧化氢溶液已部分变质或装置气密性不好
过氧化氢溶液已部分变质或装置气密性不好
.(6)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰.正确操作的先后顺序是
bcda
bcda
(填写选项序号)a.烘干 b.溶解 c.过滤 d.洗涤
(7)实验室利用F装置制备氢气,事先将锌粒放于有孔隔板之上,然后从另一端加入稀盐酸,装置F相对于装置B制备氢气,具有的优点是
可控制反应的发生与否
可控制反应的发生与否
.若用L装置收集氢气,则气体从b
b
端通入(填“a”或“b”,下同);若要将L装置中的氢气用水排出,则水从a
a
端通入.(8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物的方法制取氨气(NH3),同时还生成氯化钙(CaCl2)和水,则该反应的符号表达式为
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
;另外,氨气有刺激性气味且极易溶于水,则在实验室里氨气的制取装置是
| ||
AK或AE
AK或AE
.小军设计了如乙图图1所示的一个实验:充满氨气的一支试管倒置于一个装有足量水的烧杯中.一段时间后,将会看到:试管中充满水
试管中充满水
.(9)某化学小组在学习了制取O2后,他们发现在实验室里用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是
加热使水分蒸发加快,氧气过于潮湿
加热使水分蒸发加快,氧气过于潮湿
.为了验证此猜想是否正确,兴趣小组的同学经过热烈讨论,制定了实验方案如乙图图2并进行了实验.
第一组同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,一段时间后,用带火星的木条检验,木条复燃;
第二组同学在5%的H2O2溶液中加入2滴新制氢氧化钠溶液,加热一段时间后,用带火星木条检验,木条复燃;
第三组同学从实验装置上进行了改进,效果很好(见乙图图2).
在实验基础上,同学们经过交流讨论,得出了一些结论:
①由第一组实验可得出影响H2O2分解产生O2多少及快慢的因素之一是
过氧化氢溶液的浓度;
过氧化氢溶液的浓度;
;②由第二组实验可分析得出氢氧化钠所起的作用可能是
催化作用
催化作用
;③第三组实验验证了实验前同学们猜想的正确性.其中浓硫酸的作用是
吸收氧气中的水分
吸收氧气中的水分
;④小李同学认真观察了第三组同学的实验装置,提出了一种简单的改进装置,经现场实验,效果很好,请你说出他改进的地方:
用冷毛巾裹住玻璃导管或用排水法收集
用冷毛巾裹住玻璃导管或用排水法收集
.34、实验室里有一瓶标签残缺的盐酸,请你来共同探究.
(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述中的
A.讨论 B.调查 C.实验 D.上网
具体的做法是
(2)粗略测定该盐酸每毫升溶液中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第1步,在小烧杯中加入10g 5%的NaOH溶液;
第2步,向上述烧杯中滴入2滴酚酞试液;
第3步,向10mL的量筒里注入该盐酸至一定刻度;
第4步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,…一直滴到溶液由红色刚刚变成无色为止;
第5步,记录实验数据;
第6步,计算,确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下面问题:
①本实验为什么要用指示剂(酚酞)?
答:
②第3步中向量筒注入盐酸,量筒中液面的位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是
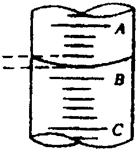
③第4步要用到玻璃棒,它是作
④第5步要记录的实验数据是
(3)测定每毫升该盐酸中含溶质HCl的质量,原理和方法还有多种,为此大家继续进行探究.有人提出用KOH等碱类试剂替代上述NaOH与盐酸进行中和反应,测定耗去盐酸的体积,通过计算确定盐酸中HCl的含量,这和上述实验属同一种方法.你能写出三种其它可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式):
方法一:
方法二:
方法三:
(4)请你在上述三种方法中,选一种,并写出按此法实验所需要的玻璃仪器.
我选的是方法
查看习题详情和答案>>
(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述中的
C
方法(填选项编号)立即确认.A.讨论 B.调查 C.实验 D.上网
具体的做法是
打开瓶塞,若有白雾冒出是浓盐酸,否则不是浓盐酸
.(2)粗略测定该盐酸每毫升溶液中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第1步,在小烧杯中加入10g 5%的NaOH溶液;
第2步,向上述烧杯中滴入2滴酚酞试液;
第3步,向10mL的量筒里注入该盐酸至一定刻度;
第4步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,…一直滴到溶液由红色刚刚变成无色为止;
第5步,记录实验数据;
第6步,计算,确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下面问题:
①本实验为什么要用指示剂(酚酞)?
答:
为了指示NaOH与HCl什么时候恰好完全中和
.②第3步中向量筒注入盐酸,量筒中液面的位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是
7.2
mL.
③第4步要用到玻璃棒,它是作
搅拌
用,目的是使反应物混合均匀,充分反应
.停止滴入盐酸后,胶头滴管中残留的盐酸应全部滴回量筒中
.④第5步要记录的实验数据是
量筒中剩下盐酸的体积
.(3)测定每毫升该盐酸中含溶质HCl的质量,原理和方法还有多种,为此大家继续进行探究.有人提出用KOH等碱类试剂替代上述NaOH与盐酸进行中和反应,测定耗去盐酸的体积,通过计算确定盐酸中HCl的含量,这和上述实验属同一种方法.你能写出三种其它可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式):
方法一:
用一定质量锌粒(或铁、镁等活泼金属)与盐酸反应,测量用去盐酸的体积
.方法二:
用一定质量CuO(或其他不溶性碱性氧化物)与盐酸反应,测量用去盐酸的体积
.方法三:
用一定质量CuO(或其他不溶性碱性氧化物)与盐酸反应,测量用去盐酸的体积
.(4)请你在上述三种方法中,选一种,并写出按此法实验所需要的玻璃仪器.
我选的是方法
①
,所需要的玻璃仪器是烧杯、量筒、胶头滴管、玻璃棒
.按下图所示装置回答下列问题。(仪器名称每个0.5分,其他1分,本题共8分)
|
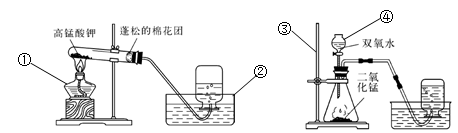 图A 图B
图A 图B(1)图示编号仪器名称:① ;② ;③ ;④ 。
(2)实验室可用装置A制取氧气。
①反应的文字表达式为 。
②用排水法集气时,说明氧气已收集满的现象是 。装满氧气的集气瓶瓶口应 (填“向上”或“向下”)放在桌面上。
(3)图A和图B装置都可以制取氧气,通过分析和归纳出发生装置是由 和
决定。
(4)图A和图B两种制取氧气的方法相比,图B方法的优点是: 。 查看习题详情和答案>>
请你与小明一起进行实验室制取二氧化碳的研究
(1) 选择药品 。小明对三组药品进行了研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
;不选择第③组药品的原因是
(2) 选择装置。他认为能选择用过氧化氢制氧气的发生装置。你认为他选择气体发生装置的依据是
(3) 制取气体。将药品装入所选装置制取气体,他认为只能用向上排空气法收集,是因为
(4) 气体检验。将生成的气体通入石蕊中,石蕊变红。原因是(用反应的文字表达式表示) 。由此实验他确定该气体一定是二氧化碳。他的检验方法是否正确?请说明理由
(5) 提供简易装置完成二氧化碳的制取、收集和验满。

上图是实验桌上摆放好的该实验所需用品,小明发现缺少一种实验仪器和一种药品,仪器名称 ;药品名称

(6) 上图是小明实验的主要步骤,这些步骤的正确顺序是 (填字母序号,下同),其中操作有误的是
(7) 如果在实验过程中要向试管中添加酸溶液,要求不改变实验装置,可选用 来完成。
(8) 如果要用上述仪器完成用高锰酸钾制取氧气,还需增加的玻璃仪器是
文字表达式
(9) 用如右图所示装置收集二氧化碳,则应该从 端
通入二氧化碳(填字母序号)
 查看习题详情和答案>>
查看习题详情和答案>>