网址:http://m.1010jiajiao.com/timu_id_887931[举报]
过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:
Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程。
 |
请回答问题:
(1)反应器中发生反应的化学方程式为 ▲ ;
(2)生产中,反应及干燥均需在较低温度下进行,原因是 ▲ ;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 ▲ 。
(4)操作A的名称是 ▲ ,若在实验室完成此操作,需要的玻璃仪器是烧杯、 ▲
和 ▲ ;
(5)洗涤过碳酸钠晶体最好选用 ▲ 。
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是 ▲ 和 ▲ ;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。
 【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:① ▲ 、④ ▲ ;
(8)实验中,水的作用是 ▲ ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是 ▲ (填化学式);
(9)实验中, ▲ ,则开始收集气体;(2分)
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g·L—1。),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数[3分,Mr(2Na2CO3·3H2O2)=314、Mr(O2)=32] ▲ ;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 ▲ ;
(12)量筒中长导管的作用是 ▲ ;
(13)有同学提出,装置中原有空气会使测定结果偏大。这种说法是否正确,如不正确,请说明理由。 ▲ ;
(14)经过讨论,小组同学一致认为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 ▲ 。
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3·3H2O2的质量分数? ▲ 。(只需给出简要的方案)
查看习题详情和答案>>过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:
Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程。
 |
请回答问题:
(1)反应器中发生反应的化学方程式为 ▲ ;
(2)生产中,反应及干燥均需在较低温度下进行,原因是 ▲ ;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 ▲ 。
(4)操作A的名称是 ▲ ,若在实验室完成此操作,需要的玻璃仪器是烧杯、 ▲
和 ▲ ;
(5)洗涤过碳酸钠晶体最好选用 ▲ 。
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是 ▲ 和 ▲ ;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。
 【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:① ▲ 、④ ▲ ;
(8)实验中,水的作用是 ▲ ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是 ▲ (填化学式);
(9)实验中, ▲ ,则开始收集气体;(2分)
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g·L—1。),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数[3分,Mr(2Na2CO3·3H2O2)=314、Mr(O2)=32] ▲ ;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 ▲ ;
(12)量筒中长导管的作用是 ▲ ;
(13)有同学提出,装置中原有空气会使测定结果偏大。这种说法是否正确,如不正确,请说明理由。 ▲ ;
(14)经过讨论,小组同学一致认为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 ▲ 。
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3·3H2O2的质量分数? ▲ 。(只需给出简要的方案)
查看习题详情和答案>>过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:
Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程。
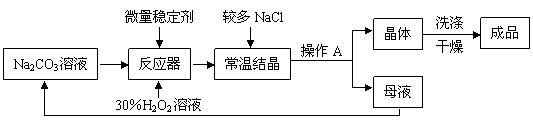 |
请回答问题:
(1)反应器中发生反应的化学方程式为 ▲ ;
(2)生产中,反应及干燥均需在较低温度下进行,原因是 ▲ ;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 ▲ 。
(4)操作A的名称是 ▲ ,若在实验室完成此操作,需要的玻璃仪器是烧杯、 ▲
和 ▲ ;
(5)洗涤过碳酸钠晶体最好选用 ▲ 。
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是 ▲ 和 ▲ ;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。
 【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并
【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并 关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:① ▲ 、④ ▲ ;
(8)实验中,水的作用是 ▲ ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是 ▲ (填化学式);
(9)实验中, ▲ ,则开始收集气体;(2分)
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g·L—1。),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数[3分,Mr(2Na2CO3·3H2O2)=314、Mr(O2)=32] ▲ ;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 ▲ ;
(12)量筒中长导管的作用是 ▲ ;
(13)有同学提出,装置中原有空气会使测定结果偏大。这种说法是否正确,如不正确,请说明理由。 ▲ ;
(14)经过讨论,小组同学一致认 为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 ▲ 。
为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 ▲ 。
(15)根据资料卡片,你还能设计出什么方案测定样品中2 Na2CO3·3H2O2的质量分数? ▲ 。(只需给出简要的方案)
Na2CO3·3H2O2的质量分数? ▲ 。(只需给出简要的方案)
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+4HCl===4NaCl+2CO2↑+O2↑+2H2O
【实验装置】

【交流与讨论】
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)装置②的作用是_________________________________________________________;
(2)装置③的作用是_________________________________________________________;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25 L(已知该实验条件下氧气的密度为1.28 g·L-1),则称取的样品质量应大于______g;
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是________;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5 g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g。则该样品的纯度为______________。
查看习题详情和答案>>过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:
Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程。
请回答问题:
(1)反应器中发生反应的化学方程式为 ;
(2)生产中,反应及干燥均需在较低温度下进行,原因是 ;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 。
(4)操作A的名称是 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、 和 ;
(5)洗涤过碳酸钠晶体最好选用 。
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是 和 ;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。
【实验步骤】:① ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:① 、④ ;
(8)实验中,水的作用是 ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是 (填化学式);
(9)实验中, ,则开始收集气体;(2分)
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g·L—1。),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数[3分,Mr(2Na2CO3·3H2O2)=314、Mr(O2)=32] ;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 ;
(12)量筒中长导管的作用是 ;
(13)有同学提出,装置中原有空气会使测定结果偏大。这种说法是否正确,如不正确,请说明理由。 ;
(14)经过讨论,小组同学一致认为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 。
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3·3H2O2的质量分数? 。(只需给出简要的方案)