摘要:化学科学探究的一般过程是:提出问题.依据已有知识和经验作出与问题有关的 .制定出解决的 .进行化学实验.查阅资料.收集证据.通过分析. .推理和 .证实.修改或 .得出合理的结论和问题的答案.
网址:http://m.1010jiajiao.com/timu_id_887609[举报]
某学生设计如下探究实验:Fe2O3对KClO3的分解反应是否有催化作用?请你一起参 与他们的探究过程,并填写下列空白.
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么? .
②为了使结论更科学、严密,还必须做的实验是: ;
③一般检验是否有氧气放出可以用 检验;
④实验1中反应的化学方程式是 ,
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为 克.
查看习题详情和答案>>
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么?
②为了使结论更科学、严密,还必须做的实验是:
③一般检验是否有氧气放出可以用
④实验1中反应的化学方程式是
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为
通过第一学期的化学学习,同学们已经掌握了实验室制取气体的一般方法,请你结合下列装置图回答问题.(友情提示:以下所选装置均填装置序号)
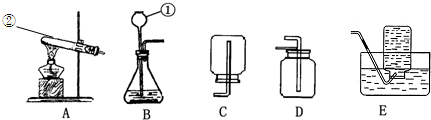
(1)写出图中指定的仪器名称:①
(2)实验室用高锰酸钾制取氧气时,可选用的发生装置是
(3)若用D装置收集氧气,验满的方法是
(4)在化学科技小组活动时,老师拿出两瓶没有标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体.为此同学们对该气体展开了一系列的探究,此气体是什么物质?验证它的实验方案如下:
查看习题详情和答案>>

(1)写出图中指定的仪器名称:①
长颈漏斗
长颈漏斗
;②试管
试管
.(2)实验室用高锰酸钾制取氧气时,可选用的发生装置是
A
A
,反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑,
| ||
2KMnO4
K2MnO4+MnO2+O2↑,
,同时用E装置收集氧气,实验停止后的操作顺序是
| ||
先将导气管从水槽中移出,再熄灭酒精灯
先将导气管从水槽中移出,再熄灭酒精灯
.(3)若用D装置收集氧气,验满的方法是
用带火星的木条放在集气瓶口,木条复燃
用带火星的木条放在集气瓶口,木条复燃
.(4)在化学科技小组活动时,老师拿出两瓶没有标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体.为此同学们对该气体展开了一系列的探究,此气体是什么物质?验证它的实验方案如下:
| 我的猜想 | 实 验 步 骤 | 实验现象 | 结论及化学方程式 |
| 此气体可能 是 二氧化碳 二氧化碳 |
某学生设计如下探究实验:Fe2O3对KClO3的分解反应是否有催化作用?请你一起参 与他们的探究过程,并填写下列空白.
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么?________.
②为了使结论更科学、严密,还必须做的实验是:________;
③一般检验是否有氧气放出可以用________检验;
④实验1中反应的化学方程式是________,
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为________克.
查看习题详情和答案>>
某学生设计如下探究实验:Fe2O3对KClO3的分解反应是否有催化作用?请你一起参 与他们的探究过程,并填写下列空白.
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么?______.
②为了使结论更科学、严密,还必须做的实验是:______;
③一般检验是否有氧气放出可以用______检验;
④实验1中反应的化学方程式是______,
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为______克.
查看习题详情和答案>>
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么?______.
②为了使结论更科学、严密,还必须做的实验是:______;
③一般检验是否有氧气放出可以用______检验;
④实验1中反应的化学方程式是______,
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为______克.
某学生设计如下探究实验:Fe2O3对KClO3的分解反应是否有催化作用?请你一起参 与他们的探究过程,并填写下列空白.
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么? .
②为了使结论更科学、严密,还必须做的实验是: ;
③一般检验是否有氧气放出可以用 检验;
④实验1中反应的化学方程式是 ,
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为 克. 查看习题详情和答案>>
提出问题:Fe2O3能不能作KClO3分解的催化剂呢?
作出猜想:Fe2O3能加快KClO3的分解速率.
实验验证:实验1:单独加热KClO3,到KClO3固体熔化以后才能检验出有氧气放出.
实验2:加热KClO3和Fe2O3的混合物,不需要很高的温度便有大量氧气放出.
得出结论:他根据实验得出结论:Fe2O3能加快KClO3的分解速率,因此Fe2O3是KClO3的分解反应的催化剂.
反思提高:
①你认为这个结论是否严密?为什么? .
②为了使结论更科学、严密,还必须做的实验是: ;
③一般检验是否有氧气放出可以用 检验;
④实验1中反应的化学方程式是 ,
若a克KClO3 加热一段时间后得到b克氧气,则剩余固体的质量为 克. 查看习题详情和答案>>