摘要:4g 请据此回答以下问题:(1)写出碳酸钠与稀盐酸反应的化学方程式 .
网址:http://m.1010jiajiao.com/timu_id_886138[举报]
某工厂生产的纯碱产品中含有少量杂质,为了验证该产品包装袋上碳酸钠≥96%的这个质量标志.某课外学习小组取11.0g该纯碱样品,用质量分数为10%的稀盐酸来进行测定(杂质不与稀盐酸反应),有关实验数据如下:
| 所加稀盐酸的质量 | 18.25g | 36.5g | 54.75g | 73.0g | 100.0g |
| 产生的CO2的质量 | 1.1g | 2.2g | 3.3g | 4.4g | 4.4g |
请据此回答以下问题:
(1)写出碳酸钠与稀盐酸反应的化学方程式______.
(2)测得11.0g该样品中所含的纯碳酸钠的质量为______ g.由此证明该产品为______(填“合格”或“不合格”)产品.
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.
某工厂生产的纯碱产品中含有少量杂质,为了验证该产品包装袋上碳酸钠≥96%的这个质量标志.某课外学习小组取11.0g该纯碱样品,用质量分数为10%的稀盐酸来进行测定(杂质不与稀盐酸反应),有关实验数据如下:
请据此回答以下问题:
(1)写出碳酸钠与稀盐酸反应的化学方程式 .
(2)测得11.0g该样品中所含的纯碳酸钠的质量为 g.由此证明该产品为
(填“合格”或“不合格”)产品.
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
| 所加稀盐酸的质量 | 18.25g | 36.5g | 54.75g | 73.0g | 100.0g |
| 产生的CO2的质量 | 1.1g | 2.2g | 3.3g | 4.4g | 4.4g |
(1)写出碳酸钠与稀盐酸反应的化学方程式 .
(2)测得11.0g该样品中所含的纯碳酸钠的质量为 g.由此证明该产品为
(填“合格”或“不合格”)产品.
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
某工厂生产的纯碱产品中含有少量杂质,为了验证该产品包装袋上碳酸钠≥96%的这个质量标志.某课外学习小组取11.0g该纯碱样品,用质量分数为10%的稀盐酸来进行测定(杂质不与稀盐酸反应),有关实验数据如下:
请据此回答以下问题:
(1)写出碳酸钠与稀盐酸反应的化学方程式 .
(2)测得11.0g该样品中所含的纯碳酸钠的质量为 g.由此证明该产品为
(填“合格”或“不合格”)产品.
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
| 所加稀盐酸的质量 | 18.25g | 36.5g | 54.75g | 73.0g | 100.0g |
| 产生的CO2的质量 | 1.1g | 2.2g | 3.3g | 4.4g | 4.4g |
(1)写出碳酸钠与稀盐酸反应的化学方程式
(2)测得11.0g该样品中所含的纯碳酸钠的质量为
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
某工厂生产的纯碱产品中含有少量杂质,为了验证该产品包装袋上碳酸钠≥96%的这个质量标志.某课外学习小组取11.0g该纯碱样品,用质量分数为10%的稀盐酸来进行测定(杂质不与稀盐酸反应),有关实验数据如下:
请据此回答以下问题:
(1)写出碳酸钠与稀盐酸反应的化学方程式______.
(2)测得11.0g该样品中所含的纯碳酸钠的质量为______ g.由此证明该产品为
______(填“合格”或“不合格”)产品.
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.

查看习题详情和答案>>
| 所加稀盐酸的质量 | 18.25g | 36.5g | 54.75g | 73.0g | 100.0g |
| 产生的CO2的质量 | 1.1g | 2.2g | 3.3g | 4.4g | 4.4g |
(1)写出碳酸钠与稀盐酸反应的化学方程式______.
(2)测得11.0g该样品中所含的纯碳酸钠的质量为______ g.由此证明该产品为
______(填“合格”或“不合格”)产品.
(3)根据实验数据,在下图上绘制出所加稀盐酸质量与生成的气体质量关系的曲线.

氮化铝(AlN)是新型的电子绝缘基片材料,用于大型和超大型集成电路中.某兴趣小组开展了制取氮化铝并测定所得样品中氮化铝的质量分数的实验.
【实验一】制取氮化铝样品
【查阅资料】在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,用此方法制得的氮化铝中含少量杂质碳和氧化铝.
【实验设计】兴趣小组的同学分成甲、乙两组,分别设计了实验.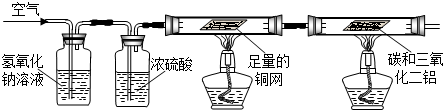
甲组:利用空气为原料,除去其它成分来获得氮气,进而和碳、三氧化二铝反应制取氮化铝.
请回答:
(1)如果洗气瓶A、B中的溶液互换位置,则空气中的 将不能除去;
(2)写出D中反应的化学方程式 ;
乙组:利用氨气为原料与氧化铜反应来获得氮气,再和碳、三氧化二铝反应制取氮化铝.
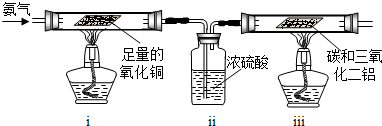
请回答:如果ⅰ中玻璃管内固体变成红色,ⅱ明显增重,请写出ⅰ中发生反应的化学方程式 ;
【实验反思】
(1)请从环保角度指出甲、乙两组实验设计中相同的不足之处: ;
(2)请比较、评价甲、乙两组实验设计中获得氮气的方法: ;
【实验二】测定所制氮化铝样品中氮化铝的质量分数
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑.
(3)氨气易溶于水且易与酸反应.
【实验设计1】甲组:用图Ⅰ装置使氮化铝样品和NaOH浓溶液反应,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数.
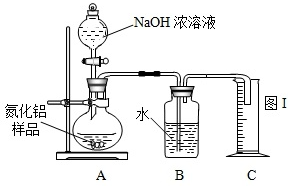
【实验反思】该设计中存在两大问题会引起偏差,请根据偏差结果填写引起相应偏差的原因:
【实验设计2】乙组:实验步骤如下:
①按下图Ⅱ组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀硫酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀硫酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀硫酸的烧杯和漏斗的总质量仍为203.4g稀硫酸
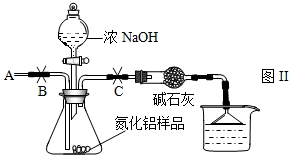
【实验讨论】
(1)步骤①加入样品前还应检查 .
(2)装有碱石灰的干燥管作用是 ;装置中使用漏斗的目的是 .
(3)如果把烧杯中的稀硫酸换成浓硫酸,测定结果会 (填“偏大”或“偏小”).
(4)步骤④的目的是 .
【实验结论】计算所制氮化铝样品中氮化铝的质量分数. 查看习题详情和答案>>
【实验一】制取氮化铝样品
【查阅资料】在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,用此方法制得的氮化铝中含少量杂质碳和氧化铝.
【实验设计】兴趣小组的同学分成甲、乙两组,分别设计了实验.

甲组:利用空气为原料,除去其它成分来获得氮气,进而和碳、三氧化二铝反应制取氮化铝.
请回答:
(1)如果洗气瓶A、B中的溶液互换位置,则空气中的
(2)写出D中反应的化学方程式
乙组:利用氨气为原料与氧化铜反应来获得氮气,再和碳、三氧化二铝反应制取氮化铝.

请回答:如果ⅰ中玻璃管内固体变成红色,ⅱ明显增重,请写出ⅰ中发生反应的化学方程式
【实验反思】
(1)请从环保角度指出甲、乙两组实验设计中相同的不足之处:
(2)请比较、评价甲、乙两组实验设计中获得氮气的方法:
【实验二】测定所制氮化铝样品中氮化铝的质量分数
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑.
(3)氨气易溶于水且易与酸反应.
【实验设计1】甲组:用图Ⅰ装置使氮化铝样品和NaOH浓溶液反应,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数.

【实验反思】该设计中存在两大问题会引起偏差,请根据偏差结果填写引起相应偏差的原因:
【实验设计2】乙组:实验步骤如下:
①按下图Ⅱ组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀硫酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀硫酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀硫酸的烧杯和漏斗的总质量仍为203.4g稀硫酸

【实验讨论】
(1)步骤①加入样品前还应检查
(2)装有碱石灰的干燥管作用是
(3)如果把烧杯中的稀硫酸换成浓硫酸,测定结果会
(4)步骤④的目的是
【实验结论】计算所制氮化铝样品中氮化铝的质量分数. 查看习题详情和答案>>