网址:http://m.1010jiajiao.com/timu_id_885199[举报]
有右图三种装置:(已知二氧化碳的密度大于空气,能溶于水)。请按要求填空:
(1)用 和 (填代号)组合成氯酸钾和二氧化锰混合制氧气装置,用该装置制氧气,待实验结束时应先将 ,然后再 。

(2)用 和 (填代号)组合成双氧水制氧气装置,请写出该反应的符号表达式 。
(3)为了得到较多的氧气,甲、乙两个化学兴趣小组分别设计了如右图所示的D,E装置。你认为可行的是 (填代号)装置。


(4)若在实验中要收集二氧化碳时,能不能用C装置收集 (答“能”或“不能”),原因是 ,若用下图装置收集二氧化碳时导管口下端位置应在 处(选填![]() 或
或![]() );检验所得气体是否为二氧化碳的方法是 。
);检验所得气体是否为二氧化碳的方法是 。
(5)收集满二氧化碳的集气瓶,应该 (填“正”或“倒”)放在桌面上。
查看习题详情和答案>>(1)根据装置图回答下列问题(装置用代号表示):

写出有编号的仪器名称:①
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
| 猜 想 | 验 证 方 法 |
| 猜想1: 与金属的活动性强弱有关 与金属的活动性强弱有关 |
将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 将形状和大小都相同的锌片和铁片,分别放入溶质质量分数和温度都相同的稀硫酸中 |
| 猜想2: 与酸的溶质质量分数有关 与酸的溶质质量分数有关 |
将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 将形状和大小都相同的两个锌片,分别放入温度相同但溶质质量分数不同的两种稀硫酸中 |
(1)根据装置图回答下列问题(装置用代号表示):
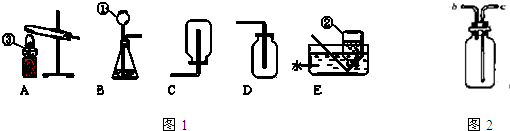
写出有编号的仪器名称:①______;②______;③______.实验室用高锰酸钾制取氧气的发生装置可选用______;实验室制取二氧化碳的发生装置可选用______.
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从______(填写导管口代号,下同)导入该装置;
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从______导入该装置.
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
| 猜 想 | 验 证 方 法 |
| 猜想1:______ | ______ |
| 猜想2:______ | ______ |
(1)根据装置图回答下列问题(装置用代号表示):

写出有编号的仪器名称:①______;②______;③______.实验室用高锰酸钾制取氧气的发生装置可选用______;实验室制取二氧化碳的发生装置可选用______.
(2)某实验小组根据所学的气体制备知识来探究SO2气体.下表是三种气体的密度(在0℃、101kPa条件下测定)和溶解度(在20℃、101kPa条件下测定).
| H2 | CO2 | SO2 | |
| 密度(g/L) | 0.08987 | 1.975 | 2.716 |
| 溶解度(g) | 0.0001603 | 0.1688 | 11.28 |
②有同学提出SO2气体会污染空气,于是采用图2装置收集SO2,则气体应该从______(填写导管口代号,下同)导入该装置;
③上述②中排出的尾气还需要用氢氧化钠溶液吸收,以防止污染环境.如果用右图装置盛氢氧化钠溶液吸收尾气,则尾气应该从______导入该装置.
(3)该实验小组查阅资料发现:大家公认对氢气的发现和研究有过很大贡献的是英国化学家卡文迪许,他于1766年发现用铁和锌等金属作用于盐酸及稀硫酸可制得氢气.同学们提出了如下问题:生成氢气的速率与哪些因素有关呢?请你帮助解决这一问题,填写下表:
| 猜 想 | 验 证 方 法 |
| 猜想1:______ | ______ |
| 猜想2:______ | ______ |
查看习题详情和答案>>
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
查看习题详情和答案>>